Page 31 - Kimya 9 | 2. Ünite
P. 31
Atom ve Periyodik Sistem
? BİLİYOR MUSUNUZ?
elektron
elektron
+ -
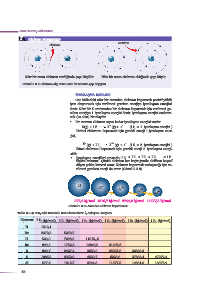
Li Li F F
Nötr bir atom elektron verdiğinde çapı küçülür. Nötr bir atom elektron aldığında çapı büyür.
Görsel 2.3.7: Elektron alıp veren nötr bir atomun çap değişimi
İYONLAŞMA ENERJİSİ
Gaz hâlindeki nötr bir atomdan elektron kopararak pozitif yüklü
iyon oluşturmak için verilmesi gereken enerjiye iyonlaşma enerjisi
denir. Nötr bir X atomundan bir elektron koparmak için verilmesi ge-
reken enerjiye 1. iyonlaşma enerjisi denir. İyonlaşma enerjisi endoter-
mik (ısı alan) bir olaydır.
• Bir atomun elektron sayısı kadar iyonlaşma enerjisi vardır.
+ -
X(g) + İ.E X (g)+ e (İ.E = 1. iyonlaşma enerjisi )
1 1
Birinci elektronu koparmak için gerekli enerji 1.iyonlaşma ener-
jisi,
+ 2+ -
X (g) + İ.E X (g) + e (İ.E = 2. iyonlaşma enerjisi )
2 2
İkinci elektronu koparmak için gerekli enerji 2. iyonlaşma enerji-
sidir.
• İyonlaşma enerjileri arasında; İ.E < İ.E < İ.E < İ.E ......< İ.E
1 2 3 4 n
ilişkisi bulunur. Çünkü elektron her koptuğunda elektron başına
düşen çekim kuvveti artar. Elektron koparmak zorlaşacağı için ve-
rilmesi gereken enerji de artar (Görsel 2.3.8).
Al +
Al 2+
Al 3+
Al 4+
Al
577,6 kj/mol 1816,7 kj/mol 2744,8 kj/mol 11577,5 kj/mol
Görsel 2.3.8: Atomdan elektron koparılması.
Tablo 2.3.4: Periyodik Sistemde Bazı Elementlerin İyonlaşma Enerjileri
Element İ.E 1 (kj/mol) İ.E 2 (kj/mol) İ.E 3 (kj/mol) İ.E 4 (kj/mol) İ.E 5 (kj/mol) İ.E 6 (kj/mol)
H 1312,1
He 2372,5 5250,7
Li 520,3 7298,5 11815,,6
Be 899,5 1752,2 14849,5 21007,6
B 800,7 2427,2 3660,0 25027,0 32828,3
C 1086,5 2352,8 4620,7 6223,0 37832,4 47279,4
Al 577,6 1816,7 2744,8 11577,5 14831,0 18377,9
84