Page 24 - Kimya 9 | 3. Ünite
P. 24
Kimyasal Türler Arası Etkileşimler
- -
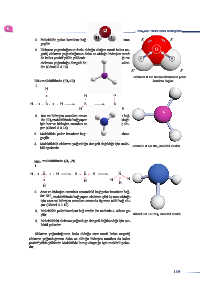
3. Molekülde polar kovalent bağ vardır. Bu nedenle 4. adıma δ δ
geçilir.
4. Elektron yoğunluğunun fazla olduğu oksijen tarafı kalıcı ne-
gatif, elektron yoğunluğunun daha az olduğu hidrojen tarafı
da kalıcı pozitif yükle yüklenir. Molekülde kutup oluştuğu ve
elektron yoğunluğu dengeli dağılmadığı için molekül polar-
dır (Görsel 3.3.13).
+ +
δ δ
Görsel 3.3.13: Su molekülündeki polar
BH 3 molekülünde ( 1 H, 5 B)
kovalent bağlar
1.
H
+ H H
H + B + H B B
H H H H
2. Bor ve hidrojen atomları arasındaki bağ polar kovalent bağ-
dır. BH molekülünde bağ yapan elektron çifti üç tane olduğu
3
için bor ve hidrojen atomları arasında üç tane tekli bağ olu-
şur (Görsel 3.3.14).
3. Molekülde polar kovalent bağ vardır. Bu nedenle 4. adıma
geçilir.
4. Moleküldeki elektron yoğunluğu dengeli dağıldığı için mole-
Görsel 3.3.14: BH 3 molekül modeli
kül apolardır.
NH 3 molekülünde ( 1 H, 7 N)
1.
H + N + H H N H N
+ H H H H
H
2. Azot ve hidrojen atomları arasındaki bağ polar kovalent bağ-
dır. NH molekülünde bağ yapan elektron çifti üç tane olduğu
3
için azot ve hidrojen atomları arasında üç tane tekli bağ olu-
şur (Görsel 3.3.15).
3. Molekülde polar kovalent bağ vardır. Bu nedenle 4. adıma ge-
çilir. Görsel 3.3.15: NH 3 molekül modeli
4. Moleküldeki elektron yoğunluğu dengeli dağılmadığı için mo-
lekül polardır.
Elektron yoğunluğunun fazla olduğu azot tarafı kalıcı negatif,
elektron yoğunluğunun daha az olduğu hidrojen tarafları da kalıcı
pozitif yükle yüklenir. Molekülde kutup oluştuğu için molekül polar-
dır.
119