Page 26 - Kimya 9 | 3. Ünite
P. 26
Kimyasal Türler Arası Etkileşimler
Neler Kazanılacak? Kovalent bağlı bileşiklerin sistematik adlandırması yapılacaktır.
H O, HCl, H SO , HNO , NH bileşik örneklerinin sistematik adları öğrenilecektir.
2 2 4 3 3
3.3.4. KOVALENT BİLEŞİKLERİN SİSTEMATİK
ADLANDIRILMASI
Ametal-ametal atomları, elektronlarını ortaklaşa kullanarak ko-
valent bileşikleri oluşturur. Bir C atomu, bir O atomu ile elektronları-
nı ortak kullanırsa CO (karbon monoksit) molekülü; bir C atomu, iki
O atomu ile bir araya geldiğinde CO 2 (karbon dioksit) molekülü olu-
şur. Aynı atomlar farklı sayılarda bir araya geldiğinde farklı bileşikler
oluşur. Bu nedenle bileşikte, her bir atomun o molekül içindeki sayısı-
nı belirtmek gerekir. Bu sayılar Latince ön ek şeklinde belirtilir.
Tablo 3.1.4’te sayıların Latince adları verilmiştir.
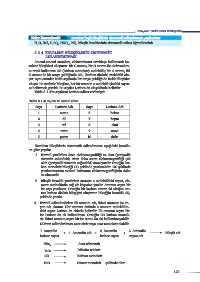
Tablo 3.1.4: Sayılar ve Latince adları
Sayı Latince Adı Sayı Latince Adı
1 mono 6 hekza
2 di 7 hepta
3 tri 8 okta
4 tetra 9 nona
5 penta 10 deka
Kovalent bileşiklerin sistematik adlandırması aşağıdaki kuralla-
ra göre yapılır:
1. Formül yazılırken önce elektronegatifliği az olan (periyodik
sistemin solundaki) atom daha sonra elektronegatifliği çok
olan (periyodik sistemin sağındaki) atom yazılır. Örneğin kar-
bon monoksit bileşiği CO şeklinde yazılmalıdır. OC şeklinde
yazılmamasının nedeni karbonun elektronegatifliğinin daha
az olmasıdır.
2. Bileşik formülü yazılırken atomun o moleküldeki sayısı, ele-
ment sembolünün sağ alt köşesine yazılır. Atomun sayısı bir
ise sayı yazılmaz. Örneğin bir karbon atomu iki oksijen ato-
mu karbon dioksit bileşiğini oluşturur. Bileşiğin formülü CO 2
şeklinde yazılır.
3. Formül adlandırılırken ilk atomun adı, ikinci atomun ise an-
yon adı okunur. Her atomun önünde o atomun molekülün-
deki sayısı Latince ön eklerle belirtilir. İlk atomun sayısı bir
ise Latince ön ek kullanılmaz. Örneğin CO karbon monok-
sit. İkinci atomun sayısı bir ise mono ön eki kullanılmayabilir.
NO’nun adlandırılması azot oksit veya azot monoksit olabilir.
1. Ametalin 2. Ametalin 2. Ametalin
+ 1. Ametalin adı + + Bileşik adı
latince sayısı latince sayısı anyon adı
Azot tribromür
NBr 3
Difosfor trioksit
P 2 O 3
CO Karbon monoksit
N 2 O Diazot monoksit şeklinde olur.
121