Page 33 - Kimya 9 | 3. Ünite
P. 33
Kimyasal Türler Arası Etkileşimler
Neler Kazanılacak? Kimyasal türler arasındaki zayıf etkileşimler sınıflandırılırken
a) Van der Waals kuvvvetleri (dipol-dipol etkileşimleri, iyon-dipol etkileşimleri, dipol-indüklenmiş di-
pol etkileşimleri, iyon-indüklenmiş dipol etkileşimleri ve London kuvvetleri) açıklanacak.
b) Dipol-dipol etkileşimleri, iyon-dipol etkileşimleri ve London kuvvetlerinin genel etkileşim güçleri
karşılaştırılacaktır.
3.4.2. VAN DER WAALS KUVVETLERİ
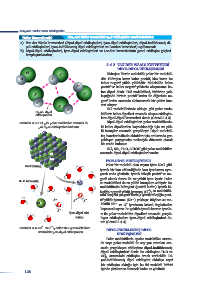
DİPOL-DİPOL ETKİLEŞİMLERİ
Cl -
δ Hidrojen klorür molekülü polar bir molekül-
H δ + dür. Hidrojen kısmı kalıcı pozitif, klor kısmı ise
kalıcı negatif yükle yüklüdür. Molekülde kalıcı
δ +
pozitif ve kalıcı negatif yüklerin oluşmasına ka-
- lıcı dipol denir. HCl molekülleri, birbirine yak-
-
δ δ
laştığında birinin pozitif kutbu ile diğerinin ne-
gatif kutbu arasında elektrostatik bir çekim kuv-
+
δ
- veti oluşur.
δ
+
δ HCl moleküllerinde olduğu gibi polar mole-
Dipol - dipol
etkileşimleri küllerin kalıcı dipolleri arasında oluşan etkileşim-
lere dipol-dipol kuvvetleri denir (Görsel 3.4.3).
Görsel 3.4.3: HCl gibi polar moleküller arasında di- Dipol-dipol etkileşimleri polar moleküllerde-
pol-dipol etkileşimleri bulunur. ki kalıcı dipollerden kaynaklandığı için zıt yük-
lü kutuplar arasında gerçekleşir. Dipol molekül-
ler, hareket hâlinde oldukları için aralarında ger-
çekleşen çarpışmalar nedeniyle düzensiz olarak
bir arada bulunur.
HCl, SO 2 , H 2 O, C 2 H 5 OH gibi polar moleküller
Cl - arasında dipol-dipol etkileşimleri vardır.
+
Na İYON-DİPOL ETKİLEŞİMLERİ
NaCl kristali Polar bir molekül olan suyun içine NaCl gibi
iyonik bir katı eklendiğinde katı iyonlarına ayrı-
şarak suda çözünür. İyonik bileşik pozitif ve ne-
gatif olmak üzere iki zıt yüklü iyon içerir. Polar
H 2O Molekülü +
Na su molekülleri de zıt yüklü kutuplara sahiptir. Su
molekülünün hidrojeni (pozitif kutbu) iyonik bi-
-
leşiğin negatif yüklü iyonuna (Cl ), su molekülü-
-
δ nün oksijeni (negatif kutbu) iyonik bileşiğin pozi-
+ + + +
- δ δ δ tif yüklü iyonuna (Na ) yaklaşır. Böylece su mo-
Cl - + -
δ lekülü Na ve Cl iyonlarını kristal örgüsünden
kopararak ayırır. Bu şekilde iyonik katının iyonla-
+
δ
İyon-dipol etki- rı ile polar molekülün dipolleri arasında gerçek-
leşimi leşen etkileşimlere iyon-dipol etkileşimleri de-
nir (Görsel 3.4.4).
+ -
Görsel 3.4.4: Na ve Cl iyonları ile H 2 O molekülleri DİPOL-İNDÜKLENMİŞ DİPOL
arasındaki iyon-dipol etkileşimleri
ETKİLEŞİMLERİ
Polar moleküllerle apolar moleküller arasın-
da veya polar molekül ile soy gaz atomları ara-
sında gerçekleşen etkileşime dipol-indüklenmiş
dipol etkileşimleri denir. Bu etkileşime H 2 O ve
CCl 4 arasındaki etkileşim örnek verilebilir. Di-
pol-indüklenmiş dipol etkileşimi oldukça zayıf
bir etkileşim olduğu için bu iki molekül birbiri
içinde çözünmez denecek kadar az çözünür.
128