Page 7 - Kimya 11 | 5.Ünite
P. 7
Kimyasal Tepkimelerde Hız
büyüktür. Girenler daha düşük enerjili bir duruma dönüştükleri için
tepkime dışarı enerji verir (Görsel 5.1.2). Tepkime ekzotermiktir.
E - E = ∆H < 0
ag
ai
Yukarıdaki tepkimenin tersi olan
2XY(g) + ısı X (g) + Y (g)
2
2
tepkimesinin potansiyel enerji tepkime koordinatı grafiği ise aşağıdaki
şekilde olur.
Potansiyel enerji
[X Y ]
2 2
E
E ag
ai
Ürünler
X +Y
2 2
∆H
Girenler
2XY ∆H>0
Görsel 5.1.3: Kaykayla yol alırken
Tepkime koordinatı
harcanan enerji kaza-
Grafik 5.1.2: Endotermik tepkimenin potansiyel ener- nılan enerjiden fazla
ji-tepkime koordinatı ise dışarıdan enerji
almak gerekir. Endo-
Grafik 5.1.2ʼden de anlaşılacağı gibi tepkimeye girenlerin sahip ol-
termik tepkimede de
duğu potansiyel enerji, ürünlerin sahip olduğu potansiyel enerjiden kü- yüksek enerjili duruma
çüktür. Girenler daha yüksek enerjili bir duruma dönüştükleri için tep- dönüşüm olduğu için
kime dışarıdan enerji alır (Görsel 5.1.3). Tepkime endotermiktir. tepkime ısı alır.
E - E ag = ∆H > 0
ai
ÖRNEK VE ÇÖZÜM
1. 2NOCl 2NO + Cl tepkimesinde E = 98 kj, E = 22 kj olduğuna göre tepkimenin ∆H değerini
ai
2
ag
bularak endotermik mi, ekzotermik mi olduğunu açıklayınız.
Çözüm
∆H = E - E
ag
ai
∆H = 98 - 22
∆H = 76 kj
∆H değeri pozitif olduğuna göre tepkime endotermiktir.
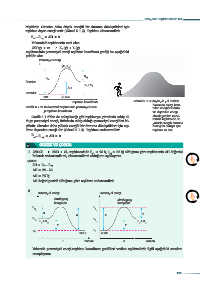
2.
Potansiyel enerji Potansiyel enerji
aktifleşmiş aktifleşmiş
kompleks kompleks
E E
P P
3 3
X Z
Z X
E E
P P
2 H +Cl 2 H +Cl
2 2 2 2
Y Y
E E
P 1 2HCI P 1 2HCI
I Zaman II Zaman
Yukarıda potansiyel enerji-tepkime koordinatı grafikleri verilen tepkimelerle ilgili aşağıdaki soruları
cevaplayınız.
193