Page 12 - Konu Özetleri AYT Kimya
P. 12
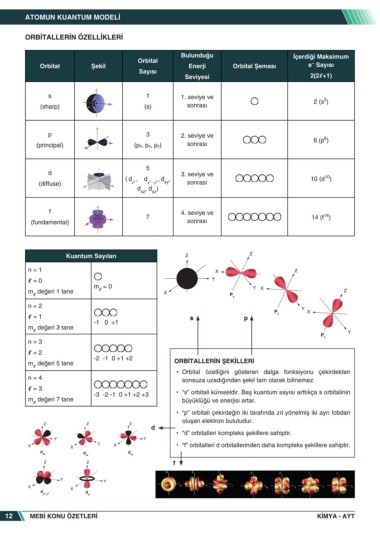
ATOMUN KUANTUM MODELI
ORBITALLERIN ÖZELLIKLERI
Bulunduğu Içerdiği Maksimum
Orbital �
Orbital Şekil Enerji Orbital Şeması e Sayısı
Sayısı
Seviyesi 2(2 +1)
s 1 1. seviye ve 2
(sharp) (s) sonrası 2 (s )
p 3 2. seviye ve 6
(principal) (px, py, pz) sonrası 6 (p )
5
d 3. seviye ve
10
( d 2 , d 2 2 , d , 10 (d )
(diffuse) z x − y xy sonrası
d , d )
xz yz
f 4. seviye ve
14
7 14 (f )
(fundamental) sonrası
Kuantum Sayıları Z Z
n = 1 X Z
= 0 Y
m = 0 Y X
m değeri 1 tane X Z
P x
n = 2 Y
Z P y X
Z
= 1 s p
-1 0 +1
m değeri 3 tane Z
X
Y
Y P z
n = 3 Y X
X Z
= 2 P x
-2 -1 0 +1 +2 Y
m değeri 5 tane P y X ORBITALLERIN ŞEKILLERI
• Orbital özelliğini gösteren dalga fonksiyonu çekirdekten
n = 4 Y sonsuza uzadığından şekil tam olarak bilinemez.
Z
Z
Z
= 3 P z
-3 -2 -1 0 +1 +2 +3 • “s” orbitali küreseldir. Baş kuantum sayısı arttıkça s orbitalinin
m değeri 7 tane büyüklüğü ve enerjisi artar. Y
Y
Y
X X X
• “p” orbitali çekirdeğin iki tarafında zıt yönelmiş iki ayrı lobdan
d
d
yz d xz xy
oluşan elektron bulutudur.
Z Z Z
d Z Z
• “d” orbitalleri kompleks şekillere sahiptir.
Y Y
Y
X X X • “f” orbitalleri d orbitallerinden daha kompleks şekillere sahiptir.
Y
Y
d d d
yz xz xy X X
Z Z f d 2 d 2 z
xy 2
Y Y
X X
d 2 d 2
xy 2 z
12 MEBİ KONU ÖZETLERİ KIMYA - AYT