Page 15 - Konu Özetleri AYT Kimya
P. 15
PERİYODİK SİSTEM VE ELEKTRON DİZİLİMLERİ
10 14
2
6
5 7
3
1
• Küresel simetri son orbitalin tam dolu ( s p d f ) ya da yarı dolu ( s p d f ) olması hâlidir.
4
2
1
Cr: .......... 4s 3d yerine 4s 3d 5
24
1
9
2
Cu: ..........4s 3d yerine 4s 3d 10
29
şeklinde küresel simetriye uygun yazılır.
• Uyarılmış hâl: İyon değildir. Elektronun olması gereken yerde olmayışıdır. Yüksek enerjili kararsız hâldir.
1
2
2
1
2
2
B: 1s 2s 2p † temel hâl B: 1s 2s 3p † uyarılmış hâl
5 5
Değerlik elektronu ve orbitali, en üst enerji seviyesindeki elektron ve orbitaldir.
�
e Dizilişi Değerlik Elektronu Değerlik Orbitali
……..3s 1 1 s
2
……..3s 3p 1 3 s, p
2
……..4s 3d 3 5 s, d
2
……..4s 3d 10 12 s, d
10
2
……..4s 3d 4p 1 3 s, p
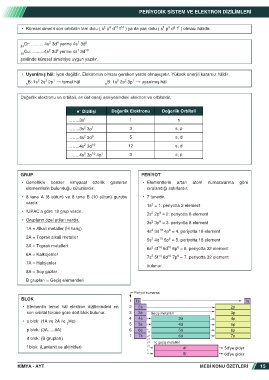
GRUP PERİYOT
• Genellikle benzer kimyasal özellik gösteren • Elementlerin artan atom numaralarına göre
elementlerin bulunduğu sütunlardır. sıralandığı satırlardır.
• 8 tane A (8 sütun) ve 8 tane B (10 sütun) gurubu • 7 tanedir.
vardır. 2
1s = 1. periyotta 2 element
• IUPAC’a göre 18 grup vardır. 2 6
2s 2p = 2. periyotta 8 element
• Grupların özel adları vardır. 2 6
3s 3p = 3. periyotta 8 element
1A = Alkali metaller (H hariç) 2 10 6
4s 3d 4p = 4. periyotta 18 element
2A = Toprak alkali metaller 2 10 6
5s 4d 5p = 5. periyotta 18 element
3A = Toprak metalleri 2 14 10 6
6s 4f 5d 6p = 6. periyotta 32 element
6A = Kalkojenler 2 14 10 6
7s 5f 6d 7p = 7. periyotta 32 element
7A = Halojenler
bulunur.
8A = Soy gazlar
B grupları = Geçiş elementleri
Periyot numarası
BLOK
1 1s 1s
• Elementin temel hâl elektron dizilimindeki en 2 2s 2p
son orbital türüne göre dört blok bulunur. 3 3s Geçiş metalleri 3p
4 4s 3d 4p
• s blok: (1A ve 2A ile He)
2 5 5s 4d 5p
p blok: (3A…..8A) 6 6s 5d 6p
7 7s 6d 7p
d blok: (B grupları)
İç geçiş metalleri
f blok: (Lantanit ve aktinitler) 4f 5d’ye gider
5f 6d’ye gider
KİMYA - AYT MEBİ KONU ÖZETLERİ 15