Page 13 - Konu Özetleri AYT Kimya
P. 13
ATOMUN KUANTUM MODELI
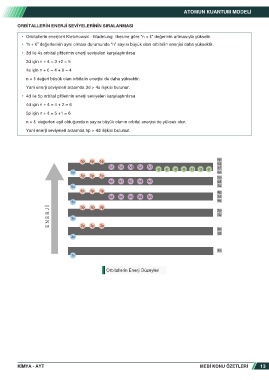
ORBITALLERIN ENERJI SEVIYELERININ SIRALANMASI
• Orbitallerin enerjileri Kletchowski - Madelung ilkesine göre “n + ℓ” değerinin artmasıyla yükselir.
• “n + ℓ” değerlerinin aynı olması durumunda “n” sayısı büyük olan orbitalin enerjisi daha yüksektir.
• 3d ile 4s orbital çiftlerinin enerji seviyeleri karşılaştırılırsa
3d için n + ℓ = 3 +2 = 5
4s için n + ℓ = 4 + 0 = 4
n + ℓ değeri büyük olan orbitalin enerjisi de daha yüksektir.
Yani enerji seviyeleri arasında 3d > 4s ilişkisi bulunur.
• 4d ile 5p orbital çiftlerinin enerji seviyeleri karşılaştırılırsa
4d için n + ℓ = 4 + 2 = 6
5p için n + ℓ = 5 +1 = 6
n + ℓ değerleri eşit olduğunda n sayısı büyük olanın orbital enerjisi de yüksek olur.
Yani enerji seviyeleri arasında 5p > 4d ilişkisi bulunur.
Orbitallerin Enerji Düzeyleri
KIMYA - AYT MEBİ KONU ÖZETLERİ 13