Page 19 - Konu Özetleri AYT Kimya
P. 19
PERIYODIK ÖZELLIKLER
3. IYONLAŞMA ENERJISI
• Temel hâlde nötr bir gaz atomundan 1 elektron koparmak için gerekli enerjiye “1. iyonlaşma enerjisi” denir.
�
+
• X(g) + Q † X (g) + 1e Q = 1. iyonlaşma enerjisidir.
DIKKAT
�
+
• X(k) + Q † X (g) + 1e Q = 1. iyonlaşma enerjisi değildir.
�
2+
• X(g) + Q † X (g) + 2e Q = 2. iyonlaşma enerjisi değildir.
• İyonlaşma enerjisi endotermiktir.
• Enerji birimi kJ/mol’dür.
• Bir atomun maksimum atom numarası kadar iyonlaşma enerjisi vardır. O’in 8 tane iyonlaşma enerjisi vardır.
8
İ.E < …….< İ.E
1 3
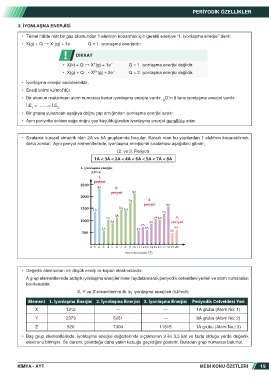
• Bir grupta yukarıdan aşağıya doğru çap arttığından iyonlaşma enerjisi azalır.
• Aynı periyotta soldan sağa doğru çap küçüldüğünden iyonlaşma enerjisi genellikle artar.
• Sıralama küresel simetrik olan 2A ve 5A gruplarında bozulur. Kararlı olan bu yapılardan 1 elektron koparabilmek
daha zordur. Aynı periyot elementlerinde, iyonlaşma enerjisinin sıralaması aşağıdaki gibidir;
(2. ve 3. Periyot)
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
(kJ/mol)
• Değerlik elektronları en düşük enerji ile kopan elektronlardır.
A grup elementlerinde ardışık iyonlaşma enerjilerinden faydalanılarak periyodik cetveldeki yerleri ve atom numaraları
belirlenebilir.
X, Y ve Z elmentlerinin ilk üç iyonlaşma enerjileri (kJ/mol):
Element 1. Iyonlaşma Enerjisi 2. Iyonlaşma Enerjisi 3. Iyonlaşma Enerjisi Periyodik Cetveldeki Yeri
X 1312 — — 1A grubu (Atom No: 1)
Y 2373 5251 — 8A grubu (Atom No: 2)
Z 520 7300 11815 1A grubu (Atom No≥ 3)
• Baş grup elementlerinde, iyonlaşma enerjisi değerlerinde sıçramanın 3 ile 3,5 kat ve fazla olduğu yerde değerlik
elektronu bitmiştir. Bu durum, çekirdeğe daha yakın kabuğa geçildiğini gösterir. Buradan grup numarası bulunur.
KIMYA - AYT MEBİ KONU ÖZETLERİ 19