Page 66 - Konu Özetleri AYT Kimya
P. 66
TEPKİME HIZINI ETKİLEYEN FAKTÖRLER
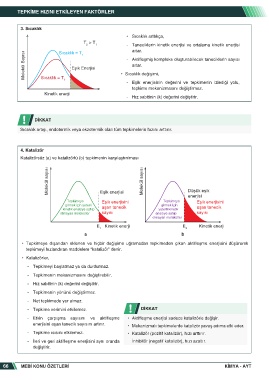
3. Sıcaklık
• Sıcaklık arttıkça,
T > T
2 1 - Taneciklerin kinetik enerjisi ve ortalama kinetik enerjisi
artar.
Sıcaklık = T
Molekül Sayısı Eşik Enerjisi • Sıcaklık değişimi,
1
- Aktifleşmiş kompleks oluşturabilecek taneciklerin sayısı
artar.
Sıcaklık = T
2
- Eşik enerjisinin değerini ve tepkimenin izlediği yolu,
tepkime mekanizmasını değiştirmez.
Kinetik enerji
- Hız sabitinin (k) değerini değiştirir.
DİKKAT
Sıcaklık artışı, endotermik veya ekzotermik olan tüm tepkimelerin hızını arttırır.
4. Katalizör
Katalizörsüz (a) ve katalizörlü (b) tepkimenin karşılaştırılması
Molekül sayısı Molekül sayısı
Düşük eşik
Eşik enerjisi
enerjisi
Tepkimeye Eşik enerjisini Tepkimeye Eşik enerjisini
girmek için yeterli aşan tanecik girmek için aşan tanecik
kinetik enerjiye sahip yeterli kinetik
olmayan moleküller sayısı enerjiye sahip sayısı
olmayan moleküller
E Kinetik enerji E Kinetik enerji
1 2
a b
• Tepkimeye dışarıdan eklenen ve hiçbir değişime uğramadan tepkimeden çıkan aktifleşme enerjisini düşürerek
tepkimeyi hızlandıran maddelere “katalizör” denir.
• Katalizörler,
- Tepkimeyi başlatmaz ya da durdurmaz.
- Tepkimenin mekanizmasını değiştirebilir.
- Hız sabitinin (k) değerini değiştirir.
- Tepkimenin yönünü değiştirmez.
- Net tepkimede yer almaz.
- Tepkime verimini etkilemez. DİKKAT
- Etkin çarpışma sayısını ve aktifleşme • Aktifleşme enerjisi sadece katalizörle değişir.
enerjisini aşan tanecik sayısını artırır. • Mekanizmalı tepkimelerde katalizör yavaş adıma etki eder.
- Tepkime ısısını etkilemez. • Katalizör (pozitif katalizör), hızı arttırır.
- İleri ve geri aktifleşme enerjisini aynı oranda İnhibitör (negatif katalizör), hızı azaltır.
değiştirir.
66 MEBİ KONU ÖZETLERİ KİMYA - AYT