Page 87 - Konu Özetleri AYT Kimya
P. 87
KIMYA
KONU ELEKTROTLAR, ELEKTROLIT VE YARI HÜCRELER
ÖZETİ
AYT AYT AYT AYT AYT AYT AYT AYT AYT AYT AYT AYT
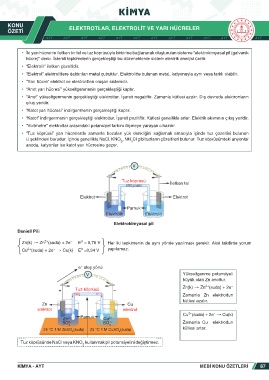
• İki yarı hücrenin iletken bir tel ve tuz köprüsüyle birbirine bağlanarak oluşturulan sisteme “elektrokimyasal pil (galvanik
hücre)” denir. İstemli tepkimelerin gerçekleştiği bu düzeneklerde sistem elektrik enerjisi üretir.
• “Elektrolit” iletken çözeltidir.
• “Elektrot” elektrolitlere daldırılan metal çubuktur. Elektrolitte bulunan metal, katyonuyla aynı veya farklı olabilir.
• “Yarı hücre” elektrot ve elektrolitten oluşan sistemdir.
• “Anot yarı hücresi” yükseltgenmenin gerçekleştiği kaptır.
• “Anot” yükseltgenmenin gerçekleştiği elektrottur. İşareti negatiftir. Zamanla kütlesi azalır. Dış devrede elektronların
çıkış yeridir.
• “Katot yarı hücresi” indirgenmenin gerçekleştiği kaptır.
• “Katot” indirgenmenin gerçekleştiği elektrottur. İşareti pozitiftir. Kütlesi genellikle artar. Elektrik akımının çıkış yeridir.
• “Voltmetre” elektrotlar arasındaki potansiyel farkını ölçmeye yarayan cihazdır.
• “Tuz köprüsü” yarı hücrelerde zamanla bozulan yük denkliğini sağlamak amacıyla içinde tuz çözeltisi bulunan
U şeklindeki borudur. İçinde genellikle NaCl, KNO , NH Cl gibi tuzların çözeltileri bulunur. Tuz köprüsündeki anyonlar
3 4
anoda, katyonlar ise katot yarı hücresine geçer.
V
Tuz köprüsü
KNO 3 (suda) İletken tel
Elektrot Elektrot
Pamuk
Elektrolit Elektrolit
Elektrokimyasal pil
Daniell Pili
0
�
2+
Zn(k) † Zn (suda) + 2e E = 0,76 V Her iki tepkimenin de aynı yönde yazılması gerekir. Aksi takdirde yorum
0
2+
�
Cu (suda) + 2e † Cu(k) E =0,34 V yapılamaz.
�
e akış yönü
V Yükseltgenme potansiyeli
büyük olan Zn anottur.
2+
Zn(k) † Zn (suda) + 2e �
+ Tuz köprüsü
K +
NO 3 Zamanla Zn elektrodun
kütlesi azalır.
Zn Cu
elektrot elektrot
�
2+
Cu (suda) + 2e † Cu(k)
Zn 2+ Pamuk Cu 2+
SO 2 SO 2 Zamanla Cu elektrodun
4 4
25 °C 1 M ZnSO (suda) 25 °C 1 M CuSO (suda) kütlesi artar.
4
4
Tuz köprüsünde NaCI veya KNO kullanmak pil potansiyelini değiştirmez.
3
KIMYA - AYT MEBİ KONU ÖZETLERİ 87