Page 89 - Kimya
P. 89
Kimya 11. Sınıf
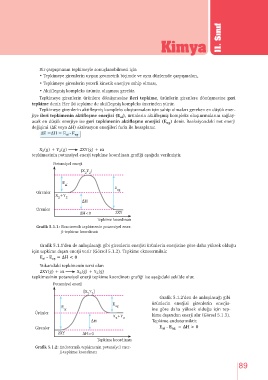
Bir çarpışmanın tepkimeyle sonuçlanabilmesi için
• Tepkimeye girenlerin uygun geometrik biçimde ve aynı düzlemde çarpışmaları,
• Tepkimeye girenlerin yeterli kinetik enerjiye sahip olması,
• Aktifleşmiş kompleks ürünün oluşması gerekir.
Tepkimeye girenlerin ürünlere dönüşmesine ileri tepkime, ürünlerin girenlere dönüşmesine geri
tepkime denir. Her iki tepkime de aktifleşmiş kompleks üzerinden yürür.
Tepkimeye girenlerin aktifleşmiş kompleks oluşturmaları için sahip olmaları gereken en düşük ener-
jiye ileri tepkimenin aktifleşme enerjisi (E ), ürünlerin aktifleşmiş kompleks oluşturmalarını sağlay-
ai
acak en düşük enerjiye ise geri tepkimenin aktifleşme enerjisi (E ) denir. Reaksiyondaki net enerji
ag
değişimi (∆E veya ∆H) aktivasyon enerjileri farkı ile hesaplanır.
∆E =∆H = E - E
ai
ag
X (g) + Y (g) 2XY(g) + ısı
2
2
tepkimesinin potansiyel enerji tepkime koordinatı grafiği aşağıda verilmiştir.
Potansiyel enerji
[X Y ]
2 2
E
ai
E
ag
Girenler
X +Y
2 2
∆H
Ürünler
∆H<0 2XY
Tepkime koordinatı
Grafik 5.1.1: Ekzotermik tepkimenin potansiyel ener-
ji-tepkime koordinatı
Grafik 5.1.1ʼden de anlaşılacağı gibi girenlerin enerjisi ürünlerin enerjisine göre daha yüksek olduğu
için tepkime dışarı enerji verir (Görsel 5.1.2). Tepkime ekzotermiktir.
E - E = ∆H < 0
ag
ai
Yukarıdaki tepkimenin tersi olan
2XY(g) + ısı X (g) + Y (g)
2
2
tepkimesinin potansiyel enerji tepkime koordinatı grafiği ise aşağıdaki şekilde olur.
Potansiyel enerji
[X Y ]
2 2
Grafik 5.1.2ʼden de anlaşılacağı gibi
E ürünlerin enerjisi girenlerin enerjis-
E ag
ai ine göre daha yüksek olduğu için tep-
Ürünler
X +Y kime dışarıdan enerji alır (Görsel 5.1.3).
2 2
∆H Tepkime endotermiktir.
Girenler E - E ag = ∆H > 0
ai
2XY ∆H>0
Tepkime koordinatı
Grafik 5.1.2: Endotermik tepkimenin potansiyel ener-
ji-tepkime koordinatı
89