Page 26 - Fen Lisesi Fizik 12 | 4. Ünite
P. 26
4.
ÜNİTE 4.1. ATOM KAVRAMININ TARİHSEL GELİŞİMİ
4.1. ATOM KAVRAMININ TARİHSEL GELİŞİMİ
Araştırma
Feza Gürsey, Asım Orhan Barut ve Behram N. Kurşunoğlu’nun atom fiziğine katkılarını
araştırınız. Sonuçları sınıfta sunum şeklinde arkadaşlarınızla paylaşınız ve panolarda
sergileyiniz.
4.1.4. MODERN ATOM TEORİSİNE GÖRE ATOMUN ÖZELLİKLERİ
1. De Broglie hipotezinde maddeye eşlik eden de Broglie dalgaları ile Heisenberg belirsizlik ilkesinde
belirtilen maddenin parçacık ve dalga özelliğinin aynı anda belirlenememesi modern atom teorisinde
geçerlidir.
2. Bohr atom modelinde elektronların yörüngeleri, çekirdeğe olan uzaklıkları, açısal momentumları
ve enerjileri De Broglie hipotezine uygun olarak kuantumludur. Modern atom modelinde de
geçerlidir.
3. Bohr atom modelinde uyarılan elektronlar, temel hâldeki enerji seviyelerine dönerken ışıma
yapar ve yayınlanan fotonun enerjisi, enerji seviyeleri farkına eşittir.
4. Spektrum sayıları belirlenenlerden daha fazla alt çizgilere sahiptir.
5. Elektronların durumu kuantum sayıları ile ifade edilir. Her yörüngede bulunacak elektron sayısı
bellidir. Elektronun yeri hakkındaki bilgiler dalga fonksiyonundan elde edilir. Örneğin orbitallerin
açıklanmasında ilk yörüngede 2 elektron, ikinci yörüngede 8 elektron bulunması.
6. Atom çekirdeği etrafındaki her temel enerji seviyesi, belirli sayıda orbital denilen alt enerji sevi-
2
2
198 yelerinden oluşmuştur. Her enerji seviyesinde n kadar orbital, 2n kadar elektron bulunur.
7. Bohr atom modeline göre elektron çekirdek çevresinde dönerken yörüngenin çevresi, elektrona
eşlik eden dalganın tam katlarına eşittir. Modern atom modelinde de geçerlidir. Bağıntı şu şekilde
yazılabilir: 2π r n =n.λ (n yörünge numarası).
8. Elektronlar hem çekirdek etrafında dolanır hem de spin (iç açısal momentum) hareketi yapar.
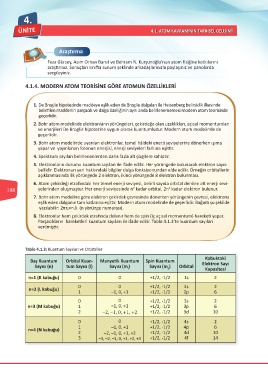
Parçacıkların hareketleri kuantum sayıları ile ifade edilir. Tablo 4.1.3’te kuantum sayıları
verilmiştir.
Tablo 4.1.3: Kuantum Sayıları ve Orbitaller
Kabuktaki
Baş Kuantum Orbital Kuan- Manyetik Kuantum Spin Kuantum Elektron Sayı
Sayısı (n) tum Sayısı (l) Sayısı (m) Sayısı (m ) Orbital
l S Kapasitesi
n=1 (K kabuğu) 0 0 +1/2, -1/2 1s 2
n=2 (L kabuğu) 0 0 +1/2, -1/2 2s 2
1 –1, 0, +1 +1/2, -1/2 2p 6
0 0 +1/2, -1/2 3s 2
n=3 (M kabuğu) 1 –1, 0, +1 +1/2, -1/2 3p 6
2 –2, –1, 0, +1, +2 +1/2, -1/2 3d 10
0 0 +1/2, -1/2 4s 2
1 –1, 0, +1 +1/2, -1/2 4p 6
n=4 (N kabuğu)
2 –2, –1, 0, +1, +2 +1/2, -1/2 4d 10
3 –3, –2, –1, 0, +1, +2, +3 +1/2, -1/2 4f 14