Page 12 - Fen Lisesi Kimya 10 | 1. Ünite
P. 12
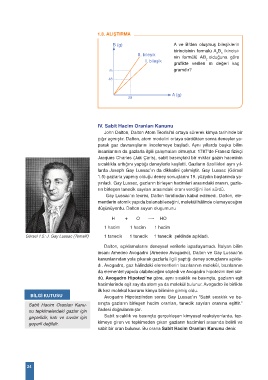
1.8. ALIŞTIRMA
B (g) A ve B’den oluşmuş bileşiklerin
birincisinin formülü A B ikincisi-
II. bileşik 2 3
nin formülü AB olduğuna göre
I. bileşik 2
grafikte verilen m değeri kaç
m gramdır?
48
A (g)
28
IV. Sabit Hacim Oranları Kanunu
John Dalton, Dalton Atom Teorisi’ni ortaya sürerek kimya tarihinde bir
çığır açmıştır. Dalton, atom modelini ortaya sürdükten sonra deneyler ya-
parak gaz davranışlarını incelemeye başladı. Aynı yıllarda başka bilim
insanlarının da gazlarla ilgili çalışmaları olmuştur. 1787’de Fransız fizikçi
Jacques Charles (Jak Çarls), sabit basınçtaki bir miktar gazın hacminin
sıcaklıkla arttığını yaptığı deneylerle keşfetti. Gazların özellikleri aynı yıl-
larda Joseph Gay Lussac’ın da dikkatini çekmiştir. Gay Lussac (Görsel
1.5) gazlarla yapmış olduğu deney sonuçlarını 19. yüzyılın başlarında ya-
yınladı. Gay Lussac, gazların birleşen hacimleri arasındaki oranın, gazla-
rın birleşen tanecik sayıları arasındaki oranı verdiğini ileri sürdü.
Gay Lussac’ın teorisi, Dalton tarafından kabul edilmedi. Dalton, ele-
mentlerin atomik yapıda bulanabileceğini, molekül hâlinde olamayacağını
düşünüyordu. Dalton suyun oluşumunu
H + O ͢ HO
1 hacim 1 hacim 1 hacim
Görsel 1.5: J. Gay Lussac (Temsilî) 1 tanecik 1 tanecik 1 tanecik şeklinde açıkladı.
Dalton, açıklamalarını deneysel verilerle ispatlayamadı. İtalyan bilim
insanı Amedeo Avogadro (Amedeo Avogadro), Dalton ve Gay Lussac’ın
kanunlarından yola çıkarak gazlarla ilgili yaptığı deney sonuçlarını açıkla-
dı. Avogadro, gaz hâlindeki elementlerin bazılarının molekül, bazılarının
da elementel yapıda olabileceğini söyledi ve Avogadro hipotezini ileri sür-
dü. Avogadro Hipotezi’ne göre, aynı sıcaklık ve basınçta, gazların eşit
hacimlerinde eşit sayıda atom ya da molekül bulunur. Avogadro ile birlikte
ilk kez molekül kavramı kimya bilimine girmiş oldu.
BİLGİ KUTUSU Avogadro Hipotezi’nden sonra Gay Lussac’ın “Sabit sıcaklık ve ba-
sınçta gazların birleşen hacim oranları, tanecik sayıları oranına eşittir.”
Sabit Hacim Oranları Kanu-
ifadesi doğrulanmıştır.
nu tepkimelerdeki gazlar için
Sabit sıcaklık ve basınçta gerçekleşen kimyasal reaksiyonlarda, tep-
geçerlidir, katı ve sıvılar için
kimeye giren ve tepkimeden çıkan gazların hacimleri arasında belirli ve
geçerli değildir.
sabit bir oran bulunur. Bu orana Sabit Hacim Oranları Kanunu denir.
24