Page 37 - Kimya 11 | Kazanım Kavrama Etkinlikleri
P. 37
10 KİMYA 11 Ortaöğretim Genel Müdürlüğü
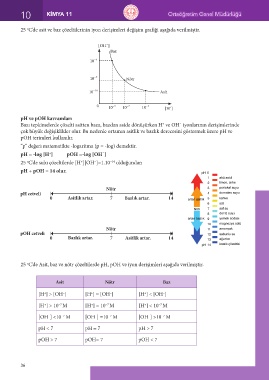
25 C’de asit ve baz çözeltilerinin iyon derişimleri değişim grafiği aşağıda verilmiştir.
o
[OH ]
−
Baz
10¯ 5
10¯ 7 Nötr
10¯ 10 Asit
0 10¯ 9 10¯ 7 10¯ 4 [H ]
+
pH ve pOH kavramları
Bazı tepkimelerde çözelti asitten baza, bazdan aside dönüşürken H ve OH¯ iyonlarının derişimlerinde
+
çok büyük değişiklikler olur. Bu nedenle ortamın asitlik ve bazlık derecesini göstermek üzere pH ve
pOH terimleri kullanılır.
“p” değeri matematikte -logaritma (p = -log) demektir.
pH = -log [H ] pOH =-log [OH¯]
+
25 C’de sulu çözeltilerde [H ][OH ]=1.10 olduğundan
−
+
o
−14
pH + pOH = 14 olur.
Nötr
pH cetveli
0 Asitlik artar. 7 Bazlık artar. 14
Nötr
pOH cetveli
0 Bazlık artar. 7 Asitlik artar. 14
25 C’de Asit, baz ve nötr çözeltilerde pH, pOH ve iyon derişimleri aşağıda verilmiştir.
o
Asit Nötr Baz
[H ] > [OH ] [H ] = [OH ] [H ] < [OH ]
+
+
−
−
+
−
[H ] > 10 M [H ] = 10 M [H ] < 10 M
−7
+
−7
−7
+
+
−7
−
−
−
−7
−7
[OH ] <10 M [OH ] =10 M [OH ] >10 M
pH < 7 pH = 7 pH > 7
pOH > 7 pOH= 7 pOH < 7
36