Page 47 - Kimya 11 | 1.Ünite
P. 47
Modern Atom Teorisi
ASAL GAZ ÖZELLİKLERİ VE ELEKTRON DİZİLİMİ
Periyodik sistemin 8A grubunda helyum (He), neon (Ne), argon
(Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) asal gazları (soy gazlar)
bulunur (Tablo 1.4.8).
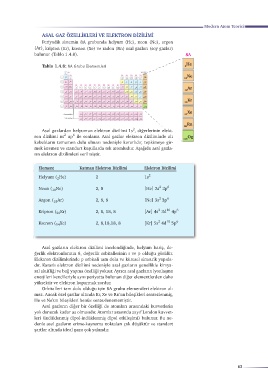
Tablo 1.4.8: 8A Grubu Elementleri
2
Asal gazlardan helyumun elektron dizilimi 1s , diğerlerinin elekt-
2 6
ron dizilimi ns np ile sonlanır. Asal gazlar elektron diziliminde alt
kabukların tamamen dolu olması nedeniyle kararlıdır, tepkimeye gir-
mek istemez ve standart koşullarda tek atomludur. Aşağıda asal gazla-
rın elektron dizilimleri verilmiştir.
Element Katman Elektron Dizilimi Elektron Dizilimi
Helyum ( He) 2 1s 2
2
2
Neon ( Ne) 2, 8 [He] 2s 2p 6
10
2
Argon ( Ar) 2, 8, 8 [Ne] 3s 3p 6
18
10
2
Kripton ( Kr) 2, 8, 18, 8 [Ar] 4s 3d 4p 6
36
2
10
Ksenon ( Xe) 2, 8,18,18, 8 [Kr] 5s 4d 5p 6
54
Asal gazların elektron dizilimi incelendiğinde, helyum hariç, de-
ğerlik elektronlarının 8, değerlik orbitallerinin s ve p olduğu görülür.
Elektron dizilimlerinde p orbitali tam dolu ve küresel simetrik yapıda-
dır. Kararlı elektron dizilimi nedeniyle asal gazların genellikle kimya-
sal aktifliği ve bağ yapma özelliği yoktur. Ayrıca asal gazların iyonlaşma
enerjileri kendileriyle aynı periyotta bulunan diğer elementlerden daha
yüksektir ve elektron koparmak zordur.
Orbitalleri tam dolu olduğu için 8A grubu elementleri elektron al-
maz. Ancak özel şartlar altında Kr, Xe ve Rn'un bileşikleri sentezlenmiş,
He ve Ne’un bileşikleri henüz sentezlenememiştir.
Asal gazların diğer bir özelliği de atomları arasındaki kuvvetlerin
yok denecek kadar az olmasıdır. Atomlar arasında zayıf London kuvvet-
leri (indüklenmiş dipol-indüklenmiş dipol etkileşimi) bulunur. Bu ne-
denle asal gazların erime-kaynama noktaları çok düşüktür ve standart
şartlar altında ideal gaza çok yakındır.
63