Page 45 - Kimya 11 | 6.Ünite
P. 45
Kimyasal Tepkimelerde Denge
Çözünürlük Çarpımı ve Çözünürlük
İyonik bileşiğin çözünürlüğü çözünürlük çarpımı ile ifade edilir.
Çözünürlük çarpımının sayısal değeri ne kadar küçükse iyonik bileşi-
ğin sudaki çözünürlüğü de o kadar azdır. K değerleri ancak deney-
çç
sel olarak elde edilebilir. Çözünürlük çarpımı büyüdükçe çözünürlük
o
artar. Örneğin 25 C’ta AgCl’ün çözünürlük çarpımı K = 1,6x10 -10 ,
çç
Al(OH) ’in çözünürlük çarpımı K = 1,8x10 -33 tür. Çözünürlük çarpım-
çç
3
larından da anlaşılacağı gibi AgCl’ün çözünürlüğü Al(OH) ’in çözünür-
3
lüğünden büyüktür.
Bir maddenin çözünürlüğü molar çözünürlük veya çözünürlük ola-
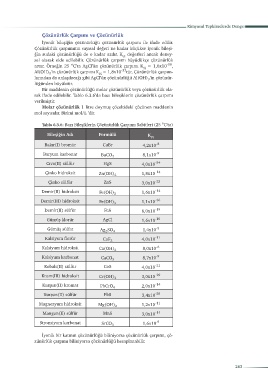
rak ifade edilebilir. Tablo 6.3.6'da bazı bileşiklerin çözünürlük çarpımı
verilmiştir.
Molar çözünürlük 1 litre doymuş çözeltideki çözünen maddenin
mol sayısıdır. Birimi mol/L ’dir.
o
Tablo 6.3.6: Bazı Bileşiklerin Çözünürlük Çarpımı Sabitleri (25 C’ta)
Bileşiğin Adı Formülü K çç
Bakır(I) bromür CuBr 4,2x10 -8
Baryum karbonat BaCO 3 8,1x10 -9
Cıva(II) sülfür HgS 4,0x10 -54
Çinko hidroksit Zn(OH) 2 1,8x10 -14
Çinko sülfür ZnS 3,0x10 -23
Demir(II) hidroksit Fe(OH) 2 1,6x10 -14
Demir(III) hidroksit Fe(OH) 3 1,1x10 -36
Demir(II) sülfür FeS 6,0x10 -19
Gümüş klorür AgCl 1,6x10 -10
Gümüş sülfat Ag SO 4 1,4x10 -5
2
Kalsiyum florür CaF 2 4,0x10 -11
Kalsiyum hidroksit Ca(OH) 2 8,0x10 -6
Kalsiyum karbonat CaCO 3 8,7x10 -9
Kobalt(II) sülfür CoS 4,0x10 -21
Krom(III) hidroksit Cr(OH) 3 3,0x10 -29
Kurşun(II) kromat PbCrO 4 2,0x10 -14
Kurşun(II) sülfür PbS 3,4x10 -28
Magnezyum hidroksit Mg(OH) 2 1,2x10 -11
Mangan(II) sülfür MnS 3,0x10 -14
Stronsiyum karbonat SrCO 3 1,6x10 -9
İyonik bir katının çözünürlüğü biliniyorsa çözünürlük çarpımı, çö-
zünürlük çarpımı biliniyorsa çözünürlüğü hesaplanabilir.
263