Page 14 - Kimya 9 | 3. Ünite
P. 14
Kimyasal Türler Arası Etkileşimler
ÖRNEK VE ÇÖZÜM
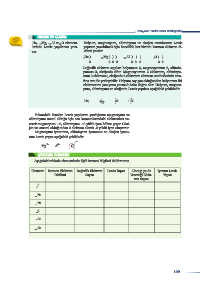
2 He, 12 Mg, 13 Al ve 8 O element- Helyum, magnezyum, alüminyum ve oksijen atomlarının Lewis
lerinin Lewis yapılarını yazı- yapısını yazabilmek için öncelikle her birinin katman elektron di-
nız. zilimi yazılır.
2 He ) 12 Mg ) ) ) 13 Al ) ) ) 8 O ) )
2 2 8 2 2 8 3 2 6
Değerlik elektron sayıları helyumun 2, magnezyumun 2, alümin-
yumun 3, oksijenin 6’dır. Magnezyumun 2 elektronu, alüminyu-
mun 3 elektronu, oksijenin 6 elektronu element sembollerinin etra-
fına sıra ile yerleştirilir. Helyum soy gaz olduğundan helyumun iki
elektronunu yan yana yazmak daha doğru olur. Helyum, magnez-
yum, alüminyum ve oksijenin Lewis yapıları aşağıdaki şekildedir.
He Mg Al O
Yukarıdaki örnekte Lewis yapılarını yazdığımız magnezyum ve
alüminyum metal olduğu için son katmanlarındaki elektronları ve-
rerek magnezyum +2, alüminyum +3 yüklü iyon hâline geçer. Oksi-
jen ise ametal olduğundan 2 elektron alarak -2 yüklü iyon oluşturur.
Magnezyum iyonunun, alüminyum iyonunun ve oksijen iyonu-
nun Lewis yapısı aşağıdaki şekildedir.
2-
2+ 3+ O
Mg Al
ÇÖZEREK ÖĞRENİN
Aşağıdaki tabloda elementlerle ilgili istenen bilgileri doldurunuz.
Element Katman Elektron Değerlik Elektron Lewis Yapısı Alacağı ya da İyonun Lewis
Dizilimi Sayısı Vereceği Elekt- Yapısı
ron Sayısı
F
9
Ne
10
Na
11
S
16
Ar
18
Ca
20
109