Page 160 - Dört Dörtlük Konu Pekiştirme Testi - AYT KİMYA
P. 160
Tepkimelerde Isı Değişimi - Oluşum Entalpisi - Tepkime Isılarının
KİMYA Toplanabilirliği ÇÖZÜMLÜ SORULAR
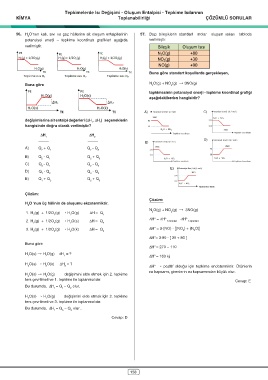
56. H O'nun katı, sıvı ve gaz hâllerine ait oluşum entalpilerinin 57. Bazı bileşiklerin standart molar oluşum ısıları tabloda
2
potansiyel enerji – tepkime koordinatı grafikleri aşağıda verilmiştir.
verilmiştir. Bileşik Oluşum Isısı
PE PE PE
1
1
1
PE H (g)+ O (g) PE H (g)+ O (g) PE H (g)+ O (g) N O(g) +80
2
2 1 2 2 2 1 2 2 2 1 2 2
H (g)+ O (g) H (g)+ O (g) H (g)+ O (g) NO (g) +30
2
2 2 2 2 2 2 2 2 2 NO(g) +90
H O(g) H O(s) H O(k)
2
2
2
H O(g) TK H O(s) TK H O(k) TK Buna göre standart koşullarda gerçekleşen,
2
2
2
TK TK TK
Tepkime ısısı Q 1 Tepkime ısısı Q 2 Tepkime ısısı Q 3 N O(g) + NO (g) † 3NO(g)
Tepkime ısısı Q Tepkime ısısı Q Tepkime ısısı Q 2 2
1 2 3
tepkimesinin potansiyel enerji - tepkime koordinat grafiği
Buna göre
aşağıdakilerden hangisidir?
PE PE
PE PE A) Potansiyel Potansiyel B) Potansiyel
Potansiyel
Enerji (kj/mol)
Enerji (kj/mol)
Potansiyel Potansiyel
Enerji (kj/mol)
Enerji (kj/mol)
Potansiyel
Potansiyel
H O(g) H O(s) Potansiyel Enerji (kj/mol) Potansiyel Enerji (kj/mol)
Enerji (kj/mol)
Enerji (kj/mol)
H O(g) H O(s) Enerji (kj/mol) Enerji (kj/mol)
2
2
NO
2 2 90 90 NO 270 3NO
3NO
270
3NO
¢H
¢H 1 ¢H ¢H 2 NO 90 90 NO NO 3NO 270 3NO
270
1 2 90 N N O+NOO+NO 2 2 N N O+NOO+NO 2 2
270
2
2
2
2
30
110
110
30
N O+NO
H O(k)
N O+NO
H O(s)
H O(s) H O(k) N 30 O+NO N O+NO 2 2 N O+NO N O+NO 2 2
2
2
2
2
110
Tepkime
Tepkime
2
2
Tepkime
Tepkime
2 TK TK 2 TK TK 30 2 30 2 110 Tepkime 2 110 2 Tepkime
Tepkime
Tepkime
Koordinatı
Koordinatı
Koordinatı
Koordinatı
değişimlerine ait entalpi değerleri (¢H , ¢H ) seçenekle- Tepkime Koordinatı Tepkime Koordinatı
Koordinatı
Koordinatı
1 2 Koordinatı Koordinatı
Potansiyel
Potansiyel
rin hangisinde doğru olarak verilmiştir? Potansiyel Potansiyel
Potansiyel
Potansiyel
Enerji (kj/mol)
Enerji (kj/mol
Enerji (kj/mol))
Enerji (kj/mol)
C) Potansiyel D) Potansiyel
Potansiyel Enerji (kj/mol) Potansiyel Enerji (kj/mol)
Enerji (kj/mol)
Enerji (kj/mol)
¢H ¢H Enerji (kj/mol) Enerji (kj/mol)
3NO
1 2 N N O+NOO+NO 2 2 3NO
2
2
270
N O+NO
3NO
270 N O+NO 90 90 3NO
90
270
N O+NO 270 2 2 2 2 3NO 90
3NO
270 2 2 3NO 90
A) Q + Q Q - Q 110 3NO 30 30
110
3NO
2 1 2 3 3NO Tepkime 30 30 N N O+NOO+NO 2 2 Tepkime
110
110
Tepkime
2
2
Tepkime
N O+NO
110 30 N O+NO 2
2
Tepkime
Tepkime
Koordinatı
Koordinatı
Koordinatı
Koordinatı
N O+NO
B) Q - Q Q + Q Tepkime 2 2 Tepkime
2
2 1 2 3 Tepkime Koordinatı 2 Tepkime Koordinatı
Koordinatı
Koordinatı
C) Q - Q Q - Q Koordinatı Koordinatı
2 1 2 3 Potansiyel
Potansiyel
D) Q - Q 2 Q - Q 2 E) Potansiyel Potansiyel
Enerji (kj/mol)
Enerji (kj/mol)
Potansiyel
3
1
Enerji (kj/mol)
Enerji (kj/mol)
E) Q + Q Q + Q Enerji (kj/mol) 3NO
3NO
1 2 2 3 270 3NO
270
3NO
270
270
3NO
270
110
110
Çözüm: 110 N N O+NOO+NO 2 2 Tepkime
110
Tepkime
2
2
N O+NO
110 N O+NO
Koordinatı
Koordinatı
Tepkime
N O+NO 2 2 2 2 Tepkime
2 2 Tepkime Koordinatı
H O ‘nun üç hâlinin de oluşumu ekzotermiktir. Koordinatı
2 Koordinatı
1. H (g) + 1/2O (g) † H O(g) ¢H = Q
2 2 2 1
Çözüm:
2. H (g) + 1/2O (g) † H O(s) ¢H = Q 2
2
2
2
N O(g) + NO (g) † 3NO(g)
3. H (g) + 1/2O (g) † H O(k) ¢H = Q 2 2
2 2 2 3
¢H° = ¢H° f (ürünler) -¢H° f (girenler)
Buna göre ¢H° = 3·(NO) - [(NO ) + (N O)]
2 2
H O(s) † H O(g) ¢H = ? ¢H°= 3·90 - [ 30 + 80 ]
2 2 1
H O(s) † H O(k) ¢H = ? ¢H°= 270 – 110
2 2 2
¢H°= 160 kj
H O(s) † H O(g) değişimini elde etmek için 2. tepkime
2 2
ters çevrilmeli ve 1. tepkime ile toplanmalıdır.
¢H° † pozitif olduğu için tepkime endotermiktir. Ürünlerin
Bu durumda, ¢H = Q – Q olur.
1 1 2 ısı kapsamı, girenlerin ısı kapsamından büyük olur.
H O(s) † H O(g) değişimini elde etmek için 2. tepkime Cevap: E
2 2
ters çevrilmeli ve 3. tepkime ile toplanmalıdır.
Bu durumda, ¢H = Q – Q olur .
1 3 2
Cevap: D
158