Page 156 - Dört Dörtlük Konu Pekiştirme Testi - AYT KİMYA
P. 156
Tepkimelerde Isı Değişimi - Oluşum Entalpisi - Tepkime Isılarının
KİMYA Toplanabilirliği ÇÖZÜMLÜ SORULAR
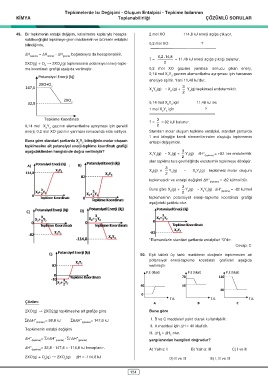
49. Bir tepkimenin entalpi değişimi, kalorimetre kaplarıyla hesapla- 2 mol XO 114,8 kJ enerji açığa çıkıyor.
nabileceği gibi tepkimeye giren maddelerin ve ürünlerin entalpisi
bilindiğinde, 0,2 mol XO ?
¢H = ¢H - ¢H bağıntısıyla da hesaplanabilir.
tepkime ürünler girenler 0,2 .14,8
? = = 11,48 kJ enerji açığa çıktığı bulunur.
2XO(g) + O † 2XO (g) tepkimesinin potansiyel enerji-tepki- 2
2 2
me koordinatı grafiği aşağıda verilmiştir. 0,2 mol XO gazının yanması sonucu çıkan enerji,
0,14 mol X Y gazının elementlerine ayrışması için harcanan
Potansiyel enerji (kj) 2 3
enerjiye eşittir. Yani 11,48 kJ’dur.
2XO+O 2 3
147,6 X Y (g) † X (g) + Y (g) tepkimesi endotermiktir.
2 3 2 2
2
Potansiyel enerji (kj)
Potansiyel enerji (kj) Potansiyel enerji (kj) 0,14 mol X Y için 11,48 kJ ise
Potansiyel enerji (kj)
Potansiyel enerji (kj)
Potansiyel enerji (kj)
3
2
2XO+O
1 mol X Y için ?
2
2XO+O 2 2 2XO 2 147,6 2 3
2XO+O
2XO+
2XO+OO
2
147,6 147,6 32,8 2 147,6 2XO+O 2 3 .
147,6
147,6
? = = 82 kJ/ bulunur.
0 2
Tepkime Koordinatı
Standart molar oluşum tepkime entalpisi, standart şartlarda
2XO
0,14 mol X Y gazının elementlerine ayrışması için gerekli 1 mol bileşiğin kendi elementlerinden oluştuğu tepkimenin
2
32,8
2
2XO
2XO
3
Potansiyel enerji (kj)
2XO
enerji, 0,2 mol XO gazının yanması sonucunda elde ediliyor.
32,8 32,8 32,8 2XO 2 2XO 2 2 Potansiyel enerji (kj) entalpi değişimidir.
2
32,8
32,8
2
X +Y
0
3
2
Buna göre standart şartlarda X Y bileşiğinin molar oluşum X Y (g) † X (g) + 3 Y (g) ¢H° (tepkime) = +82 ise endotermik
114,8
Tepkime Koordinatı
X +Y
2
3
2
0
0
3
2
2
2
0
0
tepkimesine ait potansiyel enerji-tepkime koordinatı grafiği 3 2
82
Tepkime Koordinatı
0
Tepkime Koordinatı
Tepkime Koordinatı
Tepkime Koordinatı
Tepkime Koordinatı
aşağıdakilerden hangisinde doğru verilmiştir? 3 olan tepkime ters çevrildiğinde ekzotermik tepkimeye dönüşür.
3
X + Y X + Y
3
2 2 2 2 Potansiyel enerji (kj) Potansiyel enerji (kj)
2 2
A) Potansiyel enerji (kj)
Potansiyel enerji (kj) Potansiyel enerji (kj) Potansiyel enerji (kj) X (g) + 2 Y (g) † X Y (g) tepkimesi molar oluşum
B) Potansiyel enerji (kj)
2
2
3
0
2
0
X +Y
Potansiyel enerji (kj)
Potansiyel enerji (kj)
Potansiyel enerji (kj)
Potansiyel enerji (kj)
Tepkime Koordinatı
Potansiyel enerji (kj)
Tepkime Koordinatı
2
3
X +Y
X +Y 3X 2+Y 3 114,8 X +Y
2 X +Y
2
114,8 114,8 2 3 2 3 X +Y 3 X +Y X +Y tepkimesidir ve entalpi değişimi ¢H° (tepkime) = -82 kJ/mol’dür. 3
82
114,8
114,8
2
114,8
Potansiyel enerji (kj) 82 Potansiyel enerji (kj) 32 2 X +Y 3X 2+Y 3 X +Y 3 3 3 Y (g) † X Y (g) ¢H° 3 = -82 kJ/mol
3
82
2
2
82
82
Buna göre X (g) +
82
X + Y
3 3 3 3 3 3 X + Y 2 2 2 2 2 3 (tepkime) 2
2
2
2
2
3
3
X + Y X + Y Tepkime Koordinatı X + Y X + Y 3 tepkimesinin potansiyel enerji–tepkime koordinatı grafiği
3
Tepkime Koordinatı
2 X + Y
2 2 X + Y
2 2 X + Y
2 X + Y
2
2 2 2 2 2 0 2 2 2 X + Y 2 2 2 2 0 22 2 2 2 2 X + Y 2 0 Tepkime Koordinatı 0 Tepkime Koordinatı
2
2
3
3
0
0 0 Tepkime Koordinatı 0 2 0 0 Tepkime Koordinatı 0 2 aşağıdaki şekilde olur.
0
X + Y
X + Y
0
0
Tepkime Koordinatı
2 Tepkime Koordinatı
2
2
2
Tepkime Koordinatı
2
2
Tepkime Koordinatı
Tepkime Koordinatı
-82 Tepkime Koordinatı Tepkime Koordinatı Tepkime Koordinatı
X +Y 3 -114,8 Potansiyel enerji (kj) Potansiyel enerji (kj)
2
Potansiyel enerji (kj) Potansiyel enerji (kj) Potansiyel enerji (kj) X +Y 3
Potansiyel enerji (kj)
Potansiyel enerji (kj)
2
D) Potansiyel enerji (kj)
Potansiyel enerji (kj)
C) Potansiyel enerji (kj)
Potansiyel enerji (kj)
Potansiyel enerji (kj)
Tepkime Koordinatı Tepkime Koordinatı
0 0
Tepkime Koordinatı
Tepkime Koordinatı
Tepkime Koordinatı Tepkime Koordinatı 3 3
Potansiyel enerji (kj)
Tepkime Koordinatı
Tepkime Koordinatı
Tepkime Koordinatı
Tepkime Koordinatı
X
0
0
0 0 0 3 Tepkime Koordinatı 3 Tepkime Koordinatı+ Y 2 X + Y 2
0
0
0
2
2
3
3
3
3
3
3
X + Y X + Y 2 2 0 X + Y X + Y X + Y 2 2 0 X + Y -82 2 2
3
3
2 2 X + Y
2 X + Y
2 2 X + Y
2 X + Y
2
2
2
2
2 2
2
2 2
2
2
-82 -82 2 82 2 X +Y 3X -82 X +Y 32 2 -114,8 -114,8 2 2 X +Y -114,8 2 2 2 X +Y 3 -114,8 X +Y 3
2
2
-82
-82
X +Y
2 X +Y
2+Y
2
-114,8
3
-114,8 +Y
X
3
2
X +Y
2
3
2
3
*Elementlerin standart şartlarda entalpileri “0”dır.
2
2
3
2
0 2 X +Y 3X 2+Y 3 3 X +Y 3 Cevap: C
-10 3 Tepkime Koordinatı Potansiyel enerji (kj)
Potansiyel enerji (kj)
X + Y
Potansiyel enerji (kj) 2 Potansiyel enerji (kj)
Potansiyel enerji (kj)
Potansiyel enerji (kj)
2
2
E)
50. Eşit kütleli üç farklı maddenin oksijenle tepkimesine ait
X +Y
2
3
potansiyel enerji-tepkime koordinatı grafikleri aşağıda
82
X +Y
X +Y 3X 2+Y
2 X +Y
82 82 2 3 2 82 3 3 X +Y 3 verilmiştir.
82
82
2
P.E (kkal) P.E (kkal) P.E (kkal)
0
Tepkime Koordinatı
0 0 0 0 -10 3 110
0
Tepkime Koordinatı
Tepkime Koordinatı
Tepkime Koordinatı
-10 -10 Tepkime Koordinatı Tepkime Koordinatı X + Y 2 70
2
-10
-10
3
2
3
3
3
X + Y X + Y 2 2 -10 X + Y 2 40 50
3
2 2 X + Y
2 X + Y
2
2
2
2 2
2
2
2
2
0 20
Çözüm: T.K. T.K. T.K.
A B C
2XO(g) † 2XO2(g) tepkimesine ait grafiğe göre Buna göre
Σn¢H° = 38,8 kJ Σn¢H° = 147,6 kJ I. B ve C maddeleri yakıt olarak kullanılabilir.
(ürünler) (girenler)
II. A maddesi için ¢H = 40 kkal'dir.
Tepkimenin entalpi değişimi
III. ¢H > ¢H olur.
B C
¢H° = Σn¢H° - Σn¢H°
(tepkime) (ürünler) (girenler) yargılarından hangileri doğrudur?
¢H° = 32,8 - 147,6 = -114,8 kJ hesaplanır.
(tepkime) A) Yalnız II B) Yalnız III C) I ve II
2XO(g) + O (g) † 2XO (g) ¢H = -114,8 kJ
2 2 D) II ve III E) I, II ve III
154