Page 10 - Fen Lisesi Kimya 11 | 5.Ünite
P. 10
Tepkimede 1 mol H ile 1 mol Cl harcanırken aynı zamanda 2 mol
2 2
HCl oluşur. H ve Cl ’nin harcanma hızları eşit, HCl’ün oluşma hızı H
2 2 2
ve Cl ’nin harcanma hızının iki katıdır. Tepkimede harcanma ve oluşma
2
hızı arasındaki ilişki yazılırken denklem katsayıları hıza bölüm olarak
alınır. Buna göre tepkimedeki maddelerin oluşma ve harcanma hızı
arasındaki ilişki
∆[H ] ∆[CI ] ∆[HCI]
2
2
– = – =+ şeklindedir.
∆t ∆t 2∆t
Ortalama tepkime hızı pozitif bir değer olduğundan tepkimenin or-
talama hızı
r = 2r = 2r şeklinde yazılır.
HCI H 2 CI 2
Kimyasal tepkimede girenlerin derişimi zamanla azaldığı için tepki-
menin ortalama tepkime hızı da azalır. Buna bağlı olarak tepkimelerde
girenlerin harcanma ve ürünlerin oluşma hızında zamanla azalma ger-
çekleşir.
Örneğin H O (suda) → H O(s) + 1/2O (g) tepkimesinde H O deri-
2 2 2 2 2 2
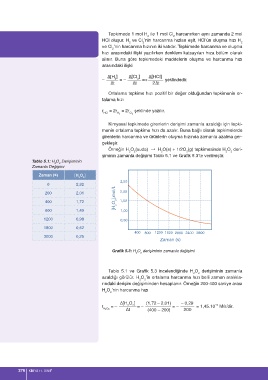
şiminin zamanla değişimi Tablo 5.1 ve Grafik 5.3’te verilmiştir.
Tablo 5.1: H O Derişiminin
2 2
Zamanla Değişimi
Zaman (s) [H O ]
2 2
2,50
0 2,32
[H 2 O 2 ],mol/L 1,50
200 2,01 2,00
400 1,72
600 1,49 1,00
1200 0,98 0,50
1800 0,62
400 800 1200 1600 2000 2400 2800
3000 0,25
Zaman (s)
Grafik 5.3: H O derişiminin zamanla değişimi
2 2
Tablo 5.1 ve Grafik 5.3 incelendiğinde H O derişiminin zamanla
2 2
azaldığı görülür. H O ’in ortalama harcanma hızı belli zaman aralıkla-
2 2
rındaki derişim değişiminden hesaplanır. Örneğin 200-400 saniye arası
H O ’nin harcanma hızı
2 2
∆[H O ] (1,72 – 2,01) – 0,29 3
2
2
r = – = – = – = 1,45.10¯ M/s’dir.
∆t (400 – 200) 200
H 2 O 2
276 KİMYA 11. SINIF