Page 15 - Fen Lisesi Kimya 11 | 5.Ünite
P. 15
KİMYASAL TEPKİMELERDE HIZ
Tablodaki veriler incelendiğinde 1 ve 2. deneyde O derişimi sabit
2
iken NO derişimi iki katına çıkarıldığında tepkime hızının dört katına Bilgi Kutusu
çıktığı görülür. Buna göre tepkime hızı NO derişiminin karesi ile doğru
Her tepkimenin kendine ait bir
orantılıdır.
hız sabiti (k) değeri vardır ve
2 ve 3. deneyde NO derişimi sabit iken O derişimi iki katına çıkarıl-
2 bu sabit değer deneysel ola-
dığında tepkime hızının iki katına çıktığı görülür. Tepkime hızı O derişi-
2 rak hesaplanır.
mi ile doğru orantılıdır. Buna göre tepkime hızı
2
r α [NO] [O ] şeklindedir.
2
Bu bağıntı eşitlik şeklinde yazılırken orantı sabiti (k = hız sabiti) ile
çarpılırsa tepkimenin hız ifadesi
2
r = k [NO] [O ] şeklinde olur.
2
Tek basamakta gerçekleşen tepkimelerde tepkimenin hız ifadesi
denklem katsayılarıyla uyumlu olduğu için tepkime hızı tepkimeye giren
maddelerin katsayılarına göre yazılır. Bu tür tepkimelerde denklem kat-
sayıları hız ifadesinde derişimlere üs olarak yazılır.
Katı ve sıvıların miktarları değiştiğinde derişimleri değişmez. Bu ne-
denle katı ve sıvılar tepkime hız ifadesinde yazılmaz.
Örneğin tek basamakta gerçekleşen
Bilgi Kutusu
aA(g) + bB(g) → cC(g) + dD(g) tepkimesinin hız ifadesi
a
b
r = k[A] [B] şeklindedir. Tepkime derecesi n olan tep-
kimelerde hız sabiti birimi (k),
Tepkimenin hız ifadesindeki madde derişimlerinin üsleri toplamına n-1
- 1
(L/mol) s olur.
tepkime derecesi (mertebesi) denir. Yukarıda verilen genel bir tepki-
menin tepkime derecesi a ve b katsayıları toplanarak bulunur.
Hız sabitinin (k) birimi her tepkime için tepkime hız ifadesinden bulu-
nur. Tepkime dereceleri eşit olan tepkimelerde hız sabitinin birimi aynıdır.
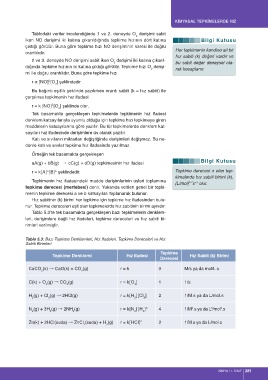
Tablo 5.3’te tek basamakta gerçekleşen bazı tepkimelerin denklem-
leri, derişimlere bağlı hız ifadeleri, tepkime dereceleri ve hız sabiti bi-
rimleri verilmiştir.
Tablo 5.3: Bazı Tepkime Denklemleri, Hız İfadeleri, Tepkime Dereceleri ve Hız
Sabiti Birimleri
Tepkime
Tepkime Denklemi Hız ifadesi Hız Sabiti (k) Birimi
Derecesi
CaCO (k) → CaO(k) + CO (g) r = k 0 M/s ya da mol/L.s
3 2
C(k) + O (g) → CO (g) r = k[O ] 1 1/s
2 2 2
H (g) + Cl (g) → 2HCl(g) r = k[H ][Cl ] 2 1/M.s ya da L/mol.s
2 2 2 2
3
3
3
N (g) + 3H (g) → 2NH (g) r = k[N ][H ] 3 4 1/M .s ya da L /mol .s
2 2 3 2 2
Zn(k) + 2HCl(suda) → ZnCl (suda) + H (g) r = k[HCl] 2 2 1/M.s ya da L/mol.s
2 2
281
KİMYA 11. SINIF