Page 17 - Fen Lisesi Kimya 11 | 5.Ünite
P. 17
KİMYASAL TEPKİMELERDE HIZ
Tepkimenin yavaş basamağı NO (g) + F (g) → NO F(g) + F(g) ol-
2 2 2
duğuna göre tepkime NO ’e göre birinci dereceden, F ’a göre birinci
2 2
dereceden, tepkime derecesi 1+1= 2 olup tepkime 2. derecedendir.
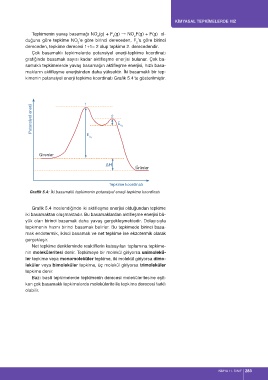
Çok basamaklı tepkimelerde potansiyel enerji-tepkime koordinatı
grafiğinde basamak sayısı kadar aktifleşme enerjisi bulunur. Çok ba-
samaklı tepkimelerde yavaş basamağın aktifleşme enerjisi, hızlı basa-
makların aktifleşme enerjisinden daha yüksektir. İki basamaklı bir tep-
kimenin potansiyel enerji tepkime koordinatı Grafik 5.4’te gösterilmiştir.
Potansiyel enerji 1 2 E a 2
E
a 1
Girenler
∆H
Ürünler
Tepkime koordinatı
Grafik 5.4: İki basamaklı tepkimenin potansiyel enerji-tepkime koordinatı
Grafik 5.4 incelendiğinde iki aktifleşme enerjisi olduğundan tepkime
iki basamaktan oluşmaktadır. Bu basamaklardan aktifleşme enerjisi bü-
yük olan birinci basamak daha yavaş gerçekleşmektedir. Dolayısıyla
tepkimenin hızını birinci basamak belirler. Bu tepkimede birinci basa-
mak endotermik, ikinci basamak ve net tepkime ise ekzotermik olarak
gerçekleşir.
Net tepkime denkleminde reaktiflerin katsayıları toplamına tepkime-
nin moleküleritesi denir. Tepkimeye bir molekül giriyorsa unimolekü-
ler tepkime veya monomoleküler tepkime, iki molekül giriyorsa dimo-
leküler veya bimoleküler tepkime, üç molekül giriyorsa trimoleküler
tepkime denir.
Bazı basit tepkimelerde tepkimenin derecesi moleküleritesine eşit-
ken çok basamaklı tepkimelerde molekülerite ile tepkime derecesi farklı
olabilir.
283
KİMYA 11. SINIF