Page 74 - Fen Lisesi Kimya 11 | 6.Ünite
P. 74
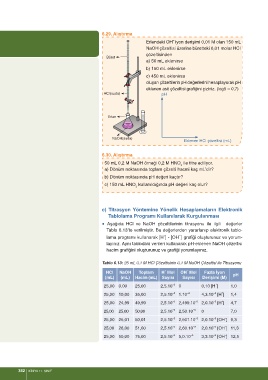
6.29. Alıştırma
Erlendeki OH¯ iyon derişimi 0,01 M olan 150 mL
NaOH çözeltisi üzerine büretteki 0,01 molar HCI
çözeltisinden
Büret
a) 50 mL eklenirse
b) 150 mL eklenirse
c) 450 mL eklenirse
oluşan çözeltilerin pH değerlerini hesaplayarak pH
eklenen asit çözeltisi grafiğini çiziniz. (log5 = 0,7)
HCI(suda) pH
Erlen
NaOH(suda)
Eklenen HCI çözeltisi (mL)
6.30. Alıştırma
50 mL 0,2 M NaOH örneği 0,2 M HNO ile titre ediliyor.
3
a) Dönüm noktasında toplam çözelti hacmi kaç mL’dir?
b) Dönüm noktasında pH değeri kaçtır?
c) 150 mL HNO kullanıldığında pH değeri kaç olur?
3
c) Titrasyon Yöntemine Yönelik Hesaplamaların Elektronik
Tablolama Programı Kullanılarak Kurgulanması
■ Aşağıda HCl ve NaOH çözeltilerinin titrasyonu ile ilgili değerler
Tablo 6.13’te verilmiştir. Bu değerlerden yararlanıp elektronik tablo-
+
lama programı kullanarak [H ] - [OH¯] grafiği oluşturunuz ve yorum-
layınız. Aynı tablodaki verileri kullanarak pH-eklenen NaOH çözeltisi
hacim grafiğini oluşturunuz ve grafiği yorumlayınız.
Tablo 6.13: 25 mL 0,1 M HCl Çözeltisinin 0,1 M NaOH Çözeltisi ile Titrasyonu
+
HCl NaOH Toplam H Mol OH¯ Mol Fazla İyon
pH
(mL) (mL) Hacim (mL) Sayısı Sayısı Derişimi (M)
+
25,00 0,00 25,00 2,5.10¯ 3 0 0,10 [H ] 1,0
+
2
25,00 10,00 35,00 2,5.10¯ 3 1.10¯ 3 4,3.10¯ [H ] 1,4
+
5
25,00 24,99 49,99 2,5.10¯ 3 2,499.10¯ 3 2,0.10¯ [H ] 4,7
25,00 25,00 50,00 2,5.10¯ 3 2,50.10¯ 3 0 7,0
5
25,00 25,01 50,01 2,5.10¯ 3 2,501.10¯ 3 2,0.10¯ [OH¯] 9,3
3
25,00 26,00 51,00 2,5.10¯ 3 2,60.10¯ 3 2,0.10¯ [OH¯] 11,3
2
25,00 50,00 75,00 2,5.10¯ 3 5,0.10¯ 3 3,3.10¯ [OH¯] 12,5
382 KİMYA 11. SINIF