Page 6 - Kimya 11 | Çalışma Defteri -7
P. 6
Hatırlıyor muyum?
Çarpışma teorisine göre etkin çarpışma sayısı arttıkça tepkime hızı artar.
Tepkimeye girenlerin madde miktarı tepkime başladığında en yüksek
seviyededir. Tepkime ilerledikçe girenler ürünlere dönüştüğü için ortamdaki
tepkimeye giren madde miktarı azalır. Dolayısıyla etkin çarpışma sayısı da
azalır. Bu nedenle kimyasal tepkimelerde tepkime ilerledikçe tepkime hızı
azalır.
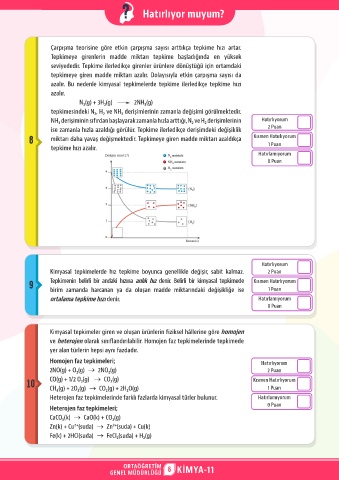
N₂(g) + 3H₂(g) 2NH₃(g)
tepkimesindeki N₂, H₂ ve NH₃ derişimlerinin zamanla değişimi görülmektedir.
NH₃ derişiminin sıfırdan başlayarak zamanla hızla arttığı, N₂ ve H₂ derişimlerinin Hatırlıyorum
ise zamanla hızla azaldığı görülür. Tepkime ilerledikçe derişimdeki değişiklik 2 Puan
8 miktarı daha yavaş değişmektedir. Tepkimeye giren madde miktarı azaldıkça Kısmen Hatırlıyorum
tepkime hızı azalır. 1 Puan
Hatırlamıyorum
0 Puan
Hatırlıyorum
Kimyasal tepkimelerde hız tepkime boyunca genellikle değişir, sabit kalmaz. 2 Puan
9 Tepkimenin belirli bir andaki hızına anlık hız denir. Belirli bir kimyasal tepkimede Kısmen Hatırlıyorum
birim zamanda harcanan ya da oluşan madde miktarındaki değişikliğe ise 1 Puan
ortalama tepkime hızı denir. Hatırlamıyorum
0 Puan
Kimyasal tepkimeler giren ve oluşan ürünlerin fiziksel hâllerine göre homojen
ve heterojen olarak sınıflandırılabilir. Homojen faz tepkimelerinde tepkimede
yer alan türlerin hepsi aynı fazdadır.
Homojen faz tepkimeleri; Hatırlıyorum
2NO(g) + O₂(g) 2NO₂(g) 2 Puan
10 CO(g) + 1/2 O₂(g) CO₂(g) Kısmen Hatırlıyorum
CH₄(g) + 2O₂(g) CO₂(g) + 2H₂O(g) 1 Puan
Heterojen faz tepkimelerinde farklı fazlarda kimyasal türler bulunur. Hatırlamıyorum
0 Puan
Heterojen faz tepkimeleri;
CaCO₃(k) CaO(k) + CO₂(g)
Zn(k) + Cu²⁺(suda) Zn²⁺(suda) + Cu(k)
Fe(k) + 2HCl(suda) FeCl₂(suda) + H₂(g)
ORTAÖĞRETİM 6 KİMYA-11
GENEL MÜDÜRLÜĞÜ