Page 80 - Kimya
P. 80
11. Sınıf Kimya 11
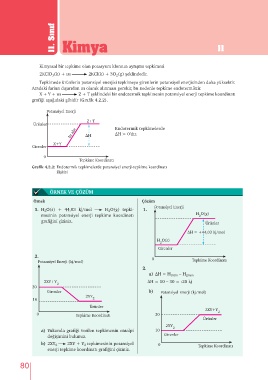
Kimyasal bir tepkime olan potasyum kloratın ayrışma tepkimesi
2KClO (k) + ısı 2KCl(k) + 3O (g) şeklindedir.
3
2
Tepkimede ürünlerin potansiyel enerjisi tepkimeye girenlerin potansiyel enerjisinden daha yüksektir.
Aradaki farkın dışarıdan ısı olarak alınması gerekir, bu nedenle tepkime endotermiktir.
X + Y + ısı Z + T şeklindeki bir endotermik tepkimenin potansiyel enerji tepkime koordinatı
grafiği aşağıdaki gibidir (Grafik 4.2.2).
Potansiyel Enerji
Z+T
Ürünler Endotermik tepkimelerde
Isı alır ∆H ∆H > 0’dır.
X+Y
Girenler
0
Tepkime Koordinatı
Grafik 4.2.2: Endotermik tepkimelerde potansiyel enerji-tepkime koordinatı
ilişkisi
ÖRNEK VE ÇÖZÜM
Örnek Çözüm
Potansiyel Enerji
1. H O(s) + 44,03 kj/mol H O(g) tepki- 1.
2
2
mesinin potansiyel enerji tepkime koordinatı H O(g)
2
grafiğini çiziniz.
Ürünler
∆H = +44,03 kj/mol
H O(s)
2
Girenler
2.
0 Tepkime Koordinatı
Potansiyel Enerji (kj/mol)
2.
a) ∆H = H ürün – H giren
2XY+Y ∆H = 10 – 30 = -20 kj
2
30
Girenler b) Potansiyel Enerji (kj/mol)
2XY
10 2
Ürünler
2XY+Y 2
0 Tepkime Koordinatı 30
Ürünler
2XY 2
a) Yukarıda grafiği verilen tepkimenin entalpi 10
değişimini bulunuz. Girenler
b) 2XY 2 2XY + Y tepkimesinin potansiyel 0 Tepkime Koordinatı
2
enerji tepkime koordinatı grafiğini çiziniz.
80