Page 78 - Kimya
P. 78
11. Sınıf Kimya
Kimya
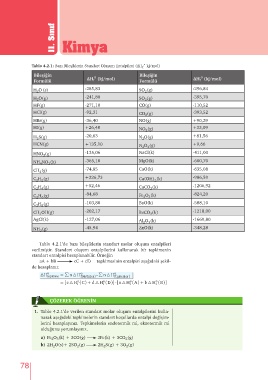
Tablo 4.2.1: Bazı Bileşiklerin Standart Oluşum Entalpileri (ΔH ˚ kj/mol)
f
Bileşiğin 0 Bileşiğin 0
ΔH (kj/mol) ΔH (kj/mol)
f
f
Formülü Formülü
H O (s) -285,83 SO (g) -296,84
2
2
H O(g) -241,80 SO (g) -395,70
3
2
HF(g) -271,10 CO(g) -110,52
HCl(g) -92,31 CO (g) -393,52
2
HBr(g) -36,40 NO(g) +90,29
HI(g) +26,48 NO (g) +33,09
2
H S(g) -20,63 N O(g) +81,56
2
2
HCN(g) +135,10 N O (g) +9,66
2 4
HNO (g) -135,06 NaCl(k) -411,00
3
NH NO (k) -365,10 MgO(k) -600,70
3
4
CH (g) -74,85 CaO(k) -635,08
4
C H (g) +226,73 Ca(OH) (k) -986,59
2
2
2
C H (g) +52,46 CaCO (k) -1206,92
3
4
2
-84,68 -824,20
C H (g) Fe O (k)
2 3
6
2
C H (g) -103,80 BaO(k) -588,10
3
8
CH OH(g) -202,17 BaCO (k) -1218,00
3
3
AgCl(k) -127,06 Al O (k) -1669,80
2 3
NH (g) -45,94 ZnO(k) -348,28
3
Tablo 4.2.1ʼde bazı bileşiklerin standart molar oluşum entalpileri
verilmiştir. Standart oluşum entalpilerini kullanarak bir tepkimenin
standart entalpisi hesaplanabilir. Örneğin
aA + bB cC + dD tepkimesinin entalpisi aşağıdaki şekil-
de hesaplanır.
3 H o tepkime = | n 3 H o f üü - | n 3 H o fgirenlerh
^
r nlerh
^
o
o
o
o
A +
C +
= 6 c 3 H ^ h d 3 H ^ h 6 a 3 H ^ h b 3 H ^ Bh@
D - @
f
f
f
f
ÇÖZEREK ÖĞRENİN
1. Tablo 4.2.1’de verilen standart molar oluşum entalpilerini kulla-
narak aşağıdaki tepkimelerin standart koşullarda entalpi değişim-
lerini hesaplayınız. Tepkimelerin endotermik mi, ekzotermik mi
olduğunu yorumlayınız.
a) Fe O (k) + 3CO(g) 2Fe(k) + 3CO (g)
2 3
2
b) 2H O(s)+ 2SO (g) 2H S(g) + 3O (g)
2
2
2
2
78