Page 11 - Fen Lisesi Kimya 11 | 4. Ünite
P. 11
KİMYASAL TEPKİMELERDE ENERJİ
Bu durumda entalpi değişimi, 1 mol C H gazı ile 7/2 mol O gazının
2 6 2
tam yanma tepkimesinden kaynaklanmaktadır. Tepkime entalpisi bilin-
diğinde tepkimede dışarıya ısı verilip verilmediği, tepkimede harcanan
ve oluşan maddelerin miktarları hesaplanabilir.
Gerçekleşme olasılığı olan milyonlarca tepkime vardır. Bu tepki-
melerin her birini standart tepkime entalpisiyle vermek uygulamada
mümkün değildir. Bununla birlikte kimyacılar önce maddelerin standart
oluşum entalpilerini belirlemişler, daha sonra herhangi bir tepkimenin
standart tepkimesini elde etmek için bu nicelikleri birleştirmişlerdir.
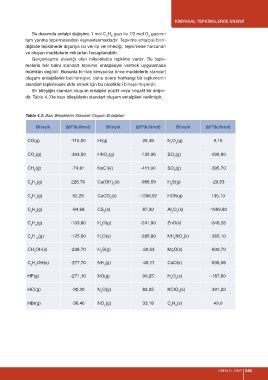
Bir bileşiğin standart oluşum entalpisi pozitif veya negatif bir değer-
dir. Tablo 4.3’te bazı bileşiklerin standart oluşum entalpileri verilmiştir.
Tablo 4.3: Bazı Bileşiklerin Standart Oluşum Entalpileri
o
o
o
Bileşik ∆H (kJ/mol) Bileşik ∆H (kJ/mol) Bileşik ∆H (kJ/mol)
CO(g) -110,50 HI(g) 26,48 N O (g) 9,16
2 4
CO (g) -393,50 HNO (g) -135,06 SO (g) -296,80
2 3 2
CH (g) -74,81 NaCI(k) -411,00 SO (g) -395,70
4 3
C H (g) 226,70 Ca(OH) (k) -986,59 H S(g) -20,63
2 2 2 2
C H (g) 52,26 CaCO (k) -1206,92 HCN(g) 135,10
2 4 3
C H (g) -84,68 CS (s) 87,30 AI O (k) -1669,80
2 6 2 2 3
C H (g) -103,80 H O(g) -241,80 ZnO(k) -348,28
3 8 2
C H (g) -125,60 H O(s) -285,80 NH NO (k) -365,10
4 10 2 4 3
CH OH(s) -238,70 H S(g) -20,63 MgO(k) -600,70
3 2
C H OH(s) -277,70 NH (g) -46,11 CaO(k) -635,08
2 5 3
HF(g) -271,10 NO(g) 90,25 H O (s) -187,60
2 2
HCI(g) -92,30 N O(g) 82,05 KCIO (s) -391,20
2 3
HBr(g) -36,40 NO (g) 33,18 C H (s) 49,0
2 6 6
245
KİMYA 11. SINIF