Page 9 - Fen Lisesi Kimya 11 | 4. Ünite
P. 9
KİMYASAL TEPKİMELERDE ENERJİ
C H (g) + 7/2O (g) → 2CO (g) + 3H O(g)
2 6 2 2 2 Tablo 4.1: Standart Şartlarda
tepkimesinde ürünlerde iki tür bileşik oluştuğundan bu tepkimedeki Elementlerin En Kararlı Hâlleri
entalpi değişimi bir bileşiğin oluşum entalpisi değildir.
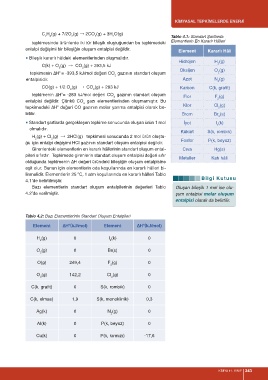
Element Kararlı Hâli
■ Bileşik kararlı hâldeki elementlerinden oluşmalıdır.
Hidrojen H (g)
C(k) + O (g) → CO (g) + 393,5 kJ 2
2 2
Oksijen O (g)
o
tepkimenin ∆H = -393,5 kJ/mol değeri CO gazının standart oluşum 2
2
entalpisidir. Azot N (g)
2
CO(g) + 1/2 O (g) → CO (g) + 283 kJ Karbon C(k, grafit)
2 2
o
tepkimenin ∆H = -283 kJ/mol değeri CO gazının standart oluşum
2 Flor F (g)
2
entalpisi değildir. Çünkü CO gazı elementlerinden oluşmamıştır. Bu
2
o
tepkimedeki ∆H değeri CO gazının molar yanma entalpisi olarak be- Klor Cl (g)
2
lirtilir. Brom Br (s)
2
■ Standart şartlarda gerçekleşen tepkime sonucunda oluşan ürün 1 mol İyot I (k)
2
olmalıdır.
Kükürt S(k, rombik)
H (g) + Cl (g) → 2HCl(g) tepkimesi sonucunda 2 mol ürün oluştu-
2 2 Fosfor P(k, beyaz)
ğu için entalpi değişimi HCl gazının standart oluşum entalpisi değildir.
Girenlerdeki elementlerin en kararlı hâllerinin standart oluşum ental- Cıva Hg(s)
pileri sıfırdır. Tepkimede girenlerin standart oluşum entalpisi değeri sıfır
Metaller Katı hâli
olduğunda tepkimenin ∆H değeri üründeki bileşiğin oluşum entalpisine
eşit olur. Bunun için elementlerin oda koşullarında en kararlı hâlleri bi-
o
linmelidir. Elementlerin 25 C, 1 atm koşullarında en kararlı hâlleri Tablo
Bilgi Kutusu
4.1’de belirtilmiştir.
Bazı elementlerin standart oluşum entalpilerinin değerleri Tablo Oluşan bileşik 1 mol ise olu-
4.2’de verilmiştir. şum entalpisi molar oluşum
entalpisi olarak da belirtilir.
Tablo 4.2: Bazı Elementlerinin Standart Oluşum Entalpileri
o
o
Element ∆H (kJ/mol) Element ∆H (kJ/mol)
H (g) 0 I (k) 0
2 2
O (g) 0 Br(s) 0
2
O(g) 249,4 F (g) 0
2
O (g) 142,2 CI (g) 0
3 2
C(k, grafit) 0 S(k, rombik) 0
C(k, elmas) 1,9 S(k, monoklinik) 0,3
Ag(k) 0 N (g) 0
2
AI(k) 0 P(k, beyaz) 0
Cu(k) 0 P(k, kırmızı) -17,6
243
KİMYA 11. SINIF