Page 34 - Fen Lisesi Kimya 9 | 2. Ünite
P. 34
Tablo 2.13: Alkali Metallerin Atom İyonlaşma enerjisi; atom yarıçapı, çekirdek yükü, kopan elektronun bu-
Yarıçapları ve 1. İyonlaşma Ener- lunduğu orbital, iç katman elektronlarının çekirdeğin oluşturduğu elektron
jileri
başına düşen çekim gücünü azaltması gibi özelliklere bağlıdır. Periyodik
Atom İE cetvelde aynı grupta yukarıdan aşağıya inildikçe atom yarıçapı arttığı için
Element Yarıçapı kJ/mol elektron koparmak için gerekli enerji azalır. Atomların iyonlaşma enerjileri
1
(pm) azalır (Tablo 2.13). Aynı periyotta soldan sağa gidildikçe atom yarıçapı
Li 152 520,2 azalırken iyonlaşma enerjileri genellikle artar.
Na 186 495,8
Tablo 2.14: 3. Periyot Elementlerinin İyonlaşma Enerjileri (kJ/mol)
K 227 418,8
Na Mg Al Si P S Cl Ar
Rb 248 403,0
İE 1 495,8 737,7 577,6 786,5 1012 996,6 1251,1 1520,5
Cs 265 375,7
Tablo 2.14 incelenirse iyonlaşma enerjileri; magnezyumun (2A) alü-
minyumdan (3A), fosforun (5A) kükürtten (6A) büyük olduğu görülür.
O hâlde aynı periyotta iyonlaşma enerjilerinin değişimi:
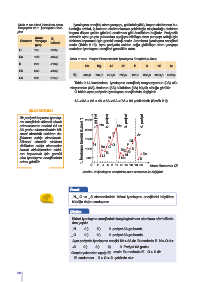
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A şeklindedir (Grafik 2.2).
BİLGİ KUTUSU
Bir periyod boyunca iyonlaş- 2500 4. periyot
ma enerjisinin düzenli olarak 1. periyot 2. periyot 3. periyot
artmamasının nedeni 2A ve He Ne
5A grubu elementlerinin kü- 2000
resel simetrik elektron da- F Ar
ğılımına sahip olmalarıdır. 1500 N
Küresel simetrik elektron 1. İyonlaşma Enerjisi (kJ.mol -1 ) CI
dizilimine sahip elementler 1000 H Be C O P
kararlı olduklarından elekt- Mg Si S
ron koparmak için gerekli Li B Al Ca
olan iyonlaşma enerjilerinde 500 Na K
artma görülür.
0 2 4 6 8 10 12 14 16 18 20 Atom Numarası (Z)
Grafik 2.2: İyonlaşma enerjisinin atom numarası ile değişimi
Örnek
N, O ve S elementlerinin birinci iyonlaşma enerjilerini büyükten
7 8 16
küçüğe doğru sıralayınız.
Çözüm
Birinci iyonlaşma enerjilerinin karşılaştırılması atomların nötr hâllerin-
den yapılır.
N 2 ) 5 ) 2. periyot 5A grubunda
7
O 2 ) 6 ) 2. periyot 6A grubunda
8
Aynı periyotta iyonlaşma enerjisi 5A > 6A dır. Bu nedenle İE N > O dur.
1
S 2 ) 8 ) 6) 3. Periyot 6A grubu
16
Grupta yukarıdan aşağı İE azalır. Bu nedenle İE O > S dir.
1 1
İE sıralaması N > O > S şeklinde olur.
1
92 93