Page 32 - Fen Lisesi Kimya 9 | 3. Ünite
P. 32
3.ÜNİTE ÖLÇME VE DEĞERLENDİRME
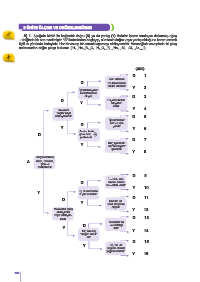
A) 1. Aşağıda birbiri ile bağlantılı doğru (D) ya da yanlış (Y) ifadeler içeren tanılayıcı dallanmış ağaç
tekniğinde bir soru verilmiştir. “A” ifadesinden başlayıp, cümlenin doğru veya yanlış olduğuna karar vererek
ilgili ok yönünde ilerleyiniz. Her bir cevap bir sonraki aşamayı etkileyecektir. Vereceğiniz cevaplarla 16 çıkış
noktasından doğru çıkışı bulunuz. ( H, He, B, C, N, O, F, Ne, Si, CI, Ar, I)
1 2 5 6 7 8 9 10 14 17 18 53
ÇIKIŞ
D 1
Son katmanı
D 8’e tamamlama
dublet kuralıdır.
Y 2
İyonik bileşikler
moleküllerden
oluşur. D 3
D H içeren bütün
Y bileşikler
asittir.
Kovalent Y 4
bağlar zayıf
etkileşimlerdir. D 5
İyonik katılar
sert ve kırıl-
D
Y gandır. Y 6
Azotun Lewis
D gösterimi; N
şeklindedir.
D 7
+
NH iyonunun
Y adı “amonyum”
4
iyonudur.
Y 8
Kimyasal türler;
A atom, molekül,
iyon ve
radikallerdir.
D 9
I – CCl ara-
2 4
D sında London
kuvvetleri vardır.
Y 10
Y B, Si elementle-
ri yarı metaldir.
D 11
D Mumun eri-
Y mesi kimyasal
olaydır.
Moleküller arası Y 12
etkileşimler
zayıf etkileşim-
lerdir. D 13
Ametaller ısı
D ve elektriği
Y iletir.
OF ’nin adı; Y 14
2
“oksijen florür”-
dür.
D 15
Y He, Ne, Ar
doğada atomik
yapıda bulunur.
Y 16
134