Page 159 - Kimya 10| Kavram Öğretimi Kitabı
P. 159
KİMYA 11
3. 2p orbitalleri eş enerjili olduğu için elektron bu orbitallere önce 2. Çizilen çapraz oklar takip edildiğinde elde edilen dizilim: 1s
2
aynı spinli olacak şekilde tek tek yerleşmeli daha sonra zıt 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
2
2
2
6
10
2
2
14
10
6
6
10
2
6
6
spinli olacak şekilde eşleşmelidir. Buna göre (a) seçeneğinde 5f 6d 7p şeklinde olur. 1. soruda elde edilen dizilim ile
14
10
6
elektronların orbitallere tek tek yerleşmediği görüldüğünden aynıdır.
Hund Kuralı’na uymaz. (b) ve (c) seçeneğinde elektronlar Hund
Kuralı’nda belirtildiği şekilde yerleşmiştir. (d) seçeneğinde ise
elektronlar ilk yerleşirken aynı spinli yerine zıt spinli yerleştiği
için Hund Kuralı’na uymaz.
7s 2 7p 6
Çalışma No.: 15
6s 2 6p 6 6d 10
1. 4p orbitali en fazla 6 elektron alabilir. Üç elektronun spin ku-
antum sayısı +1/2 olur. 5s 2 5p 6 5d 10 5f 14
2. X: 1s 2s 2p 3s 3p 4s 3d elektron dağılımı yapılır. İlk 9 or-
5
2
6
6
2
1
2
24 2 6 10 14
bital tam doludur ve 9 elektronun spin kuantum sayısı +1/2, 9 4s 4p 4d 4f
elektronun -1/2 olur. 6 tane yarı dolu orbital vardır ve buradaki
elektronların spin kuantum sayısını kesin olarak bilinemez. En 3s 2 3p 6 3d 10
fazla olması için 6 elektronun spin kuantum sayısını -1/2 olursa
9+6=15 olur. En az olması için 6 yarı dolu orbitalde bulunan 2s 2 2p 6
elektronların spin kuantum sayısını + 1/2 olursa -1/2 olan en
az 9 elektron içerir.
1s 2
3. n=3 ℓ =2 mℓ = +2 ms = +1/2
2
2
6
2
3. 40 Zr: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d
2
10
6
2
6
2
Çalışma No.: 16
1. a) 1s orbtalindeki bir elektron için, Çalışma No.: 18
n:1 ℓ:0 m : 0 m : 1 ya da
ℓ s + 1.
2 Açısal
n:1 ℓ:0 m : 0 m : 1 olabilir. Baş Momentum
ℓ s - Kuantum Orbital “mℓ=2ℓ+1” “n+ℓ”
2 Sayısı Kuantum Türü değeri değeri
2s orbitalindeki bir elektron için, 1 “n” Sayısı
“ℓ”
+
n:2 ℓ:0 m : 0 m : ya da 1 0 s 1 1
ℓ
2
s
1 0 s 1 2
-
n:2 ℓ:0 m : 0 m : olabilir. 2 1 p 3 3
s
ℓ
2
b) 2s orbitalindeki iki elektron için; 0 s 1 3
1
1.elektron; n:2 ℓ:0 m : 0 m : ise 3 1 p 3 4
s +
ℓ
2
2 d 5 5
1
-
2.elektron; n:2 ℓ:0 m : 0 m : olmalıdır. 0 s 1 4
ℓ s 2
1 p 3 5
4
2 d 5 6
Çalışma No.: 17
3 f 7 7
2
6
2
6
2
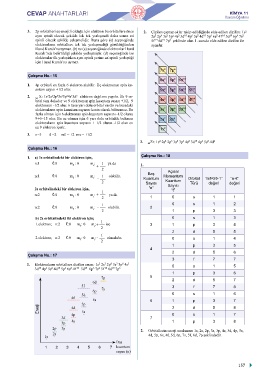
1. Elektronların orbitallere dizilim sırası: 1s 2s 2p 3s 3p 4s 0 s 1 5
2
10
6
10
6
14
2
2
14
10
10
3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 6
6
2
1 p 3 6
7p 5
6d 2 d 5 7
5f 3 f 7 8
6p 7s
5d 0 s 1 6
4f 6s 6 1 p 3 7
5p
Enerji 4d 5s 2 d 5 8
3d 4p 7 0 s 1 7
3p 4s 1 p 3 8
2p 3s 2. Orbitallerin enerji sıralaması 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s,
2s
1s 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p şeklindedir.
Baş
1 2 3 4 5 6 7 kuantum
sayısı (n)
157