Page 28 - Kimya 11 | Kazanım Kavrama Etkinlikleri
P. 28
Ortaöğretim Genel Müdürlüğü KİMYA 11 8
5. ÜNİTE: Kimyasal Tepkimelerde Hız
Konu Kimyasal Tepkimelerin Hızları 40 dk.
Kazanımlar 11.5.2.1. Tepkime hızına etki eden faktörleri açıklar.
Gerekli Materyaller: Çalışma kâğıdı
1. Yönerge
HIZ DENKLEMİ
Az sayıda taneciğin tepkimeye girdiği ve tek basamakta oluşan basit tepkimelere tek basamaklı tepki-
meler denir. Kimyasal tepkimelerin hızı ile tepkimeye giren maddelerin derişimleri arasındaki ilişkiyi
gösteren bağıntıya hız denklemi ya da tepkimenin hız ifadesi denir.
Tek basamaklı tepkilerde hız denklemi tepkimeye girenlerin derişimine göre yazılır. Denklemdeki
katsayılar derişimlere üs olarak yazılır. Saf katı ve sıvılar derişimleri değişmediğinden hız bağıntısına
yazılmaz. Sulu çözelti (suda) veya gaz (g) ise yazılır.
Örneğin tek basamakta gerçekleşen
aA(g) + bB(g) → cC(g) + dD(g) tepkimesinin hız ifadesi r = k[A] [B] şeklindedir.
a
b
Tepkimenin hız ifadesindeki madde derişimlerinin üsleri toplamına tepkime derecesi (mertebesi)
denir.
Yukarıda verilen genel bir tepkimenin tepkime derecesi a ve b katsayıları toplanarak bulunur. Hız sabi-
tinin (k) birimi her tepkime için tepkime hız ifadesinden bulunur. Hız sabiti “k” sıcaklık, temas yüzeyi
ve katalizör ile değişir. Çok basamaklı (mekanizmalı) tepkimelerde hız denklemi, yavaş basamağın
girenlerinin derişimlerine göre yazılır.
Çok basamaklı tepkimenin mekanizması
I. ara basamak NO 2 (g) + F 2 (g) → NO 2 F(g) + F(g) (yavaş)
+ II. ara basamak NO 2 (g) + F(g) → NO 2 F(g) (hızlı)
Net tepkime denklemi: 2NO 2 (g) + F 2 (g) → 2NO 2 F(g) şeklindedir.
Hız denklemi yavaş adıma göre yazılır. r=k[NO 2 ] [F 2 ] şeklinde yazılır.
Tepkime NO 2 ’e göre birinci dereceden, F 2 ’a göre birinci dereceden, tepkime derecesi 1+1= 2 olup
tepkime 2. derecedendir.
Bu tepkimede F ara üründür. Ara ürün bir kimyasal tepkimenin bir önceki basamağında oluşup bir
sonraki basamakta harcanır. Ara ürün net tepkime denkleminde yer almaz.
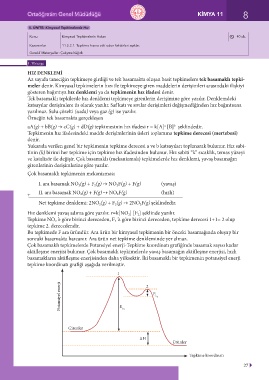
Çok basamaklı tepkimelerde Potansiyel enerji-Tepkime koordinatı grafiğinde basamak sayısı kadar
aktifleşme enerjisi bulunur. Çok basamaklı tepkimelerde yavaş basamağın aktifleşme enerjisi, hızlı
basamakların aktifleşme enerjisinden daha yüksektir. İki basamaklı bir tepkimenin potansiyel enerji
tepkime koordinatı grafiği aşağıda verilmiştir.
1
Potansiyel enerji E a 1 2 E a 2
Girenler
∆H
Ürünler
Tepkime koordinatı
27