Page 31 - Kimya 11 | Kazanım Kavrama Etkinlikleri
P. 31
8 KİMYA 11 Ortaöğretim Genel Müdürlüğü
c) Tepkimenin derecesi: 3 Moleküleritesi: 4’tür.
ç) Tepkime hız ifadesi net tepkimede girenlerin katsayısına uymadığı için tepkime çok basamaklıdır.
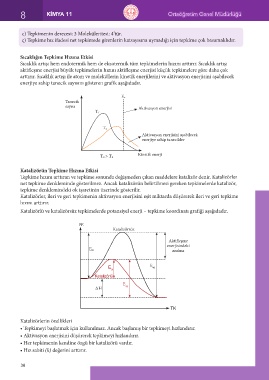
Sıcaklığın Tepkime Hızına Etkisi
Sıcaklık artışı hem endotermik hem de ekzotermik tüm tepkimelerin hızını arttırır. Sıcaklık artışı
aktifleşme enerjisi büyük tepkimelerin hızını aktifleşme enerjisi küçük tepkimelere göre daha çok
arttırır. Sıcaklık artışı ile atom ve moleküllerin kinetik enerjilerini ve aktivasyon enerjisini aşabilecek
enerjiye sahip tanecik sayısını gösteren grafik aşağıdadır.
E a
Tanecik
sayısı Aktivasyon enerjisi
T 1
T 2
Aktivasyon enerjisini aşabilecek
enerjiye sahip tanecikler
Kinetik enerji
T 2 > T 1
Katalizörün Tepkime Hızına Etkisi
Tepkime hızını arttıran ve tepkime sonunda değişmeden çıkan maddelere katalizör denir. Katalizörler
net tepkime denkleminde gösterilmez. Ancak katalizörün belirtilmesi gereken tepkimelerde katalizör,
tepkime denklemindeki ok işaretinin üzerinde gösterilir.
Katalizörler, ileri ve geri tepkimenin aktivasyon enerjisini eşit miktarda düşürerek ileri ve geri tepkime
hızını arttırır.
Katalizörlü ve katalizörsüz tepkimelerde potansiyel enerji – tepkime koordinatı grafiği aşağıdadır.
PE
Katalizörsüz
Aktifleşme
enerjisindeki
azalma
E ai
E
E ag
ai
Katalizörlü
E
∆H ag
TK
Katalizörlerin özellikleri
• Tepkimeyi başlatmak için kullanılmaz. Ancak başlamış bir tepkimeyi hızlandırır.
• Aktivasyon enerjisini düşürerek tepkimeyi hızlandırır.
• Her tepkimenin kendine özgü bir katalizörü vardır.
• Hız sabiti (k) değerini arttırır.
30