Page 56 - Kimya 10 | 1.Ünite
P. 56
Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar
II. YOL: Mol sayısı yerine madde miktarları, soruda istenilen mol, küt-
le, hacim, tanecik sayısına dönüştürülür. Madde miktarları arasındaki
ilişki tepkime üstünde kurulabileceği gibi oran orantı denklemleri sonu-
cunda da elde edilebilir.
CH 4 (g) + 2O 2 (g) CO 2 (g) + 2H 2 O(s)
TEPKİMEDE: 1 mol (O 2 :32 gram) 1 mol=22,4 litre 2 mol
2x32=64 gram
3 katı
SORUDA: 3 mol ? gram ? litre ? mol
3 x 64 = 192 gram 3 x 22,4 = 67,2 litre 3 x 2 = 6 mol
a) 1 mol CH 4 64 g O ile b) 1 mol CH 4 22 4 2 c) 1 mol CH 4 2 mol HO
,L CO
2
2
3 mol CH 4 xg 3 mol CH 4 x LCO 2 3 mol CH 4 xmol HO
2
$
x = 364 = 192 g O 2 3224$ , 32$
x = = 67 ,L CO2 x = = 6 mol HO
2
1 2 1
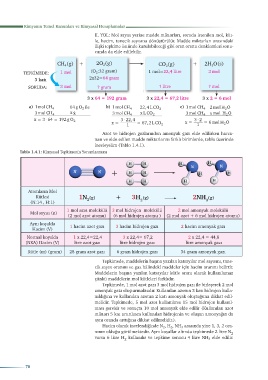
Azot ve hidrojen gazlarından amonyak gazı elde edilirken harca-
nan ve elde edilen madde miktarlarını farklı birimlerde, tablo üzerinde
inceleyelim (Tablo 1.4.1).
Tablo 1.4.1: Kimyasal Tepkimenin Yorumlanması
H H H H
N N
N N + H H H H
H H H H
Atomların Mol
Kütlesi 1N (g) + 3H (g) 2NH (g)
(N:14 , H:1) 2 2 3
1 mol azot molekülü 3 mol hidrojen molekülü 2 mol amonyak molekülü
Mol sayısı (n)
(2 mol azot atomu) (6 mol hidrojen atomu ) (2 mol azot + 6 mol hidrojen atomu)
Aynı koşulda
1 hacim azot gazı 3 hacim hidrojen gazı 2 hacim amonyak gazı
Hacim (V)
Normal koşulda 1 x 22,4=22,4 3 x 22,4= 67,2 2 x 22,4 = 44,8
(NKA) Hacim (V) litre azot gazı litre hidrojen gazı litre amonyak gazı
Kütle (m) (gram) 28 gram azot gazı 6 gram hidrojen gazı 34 gram amonyak gazı
Tepkimede, maddelerin başına yazılan katsayılar mol sayısını, tane-
cik sayısı oranını ve gaz hâlindeki maddeler için hacim oranını belirtir.
Maddelerin başına yazılan katsayılar kütle oranı olarak kullanılamaz
çünkü maddelerin mol kütleleri farklıdır.
Tepkimede, 1 mol azot gazı 3 mol hidrojen gazı ile birleşerek 2 mol
amonyak gazı oluşturmaktadır. Kullanılan azotun 3 katı hidrojen kulla-
nıldığına ve kullanılan azotun 2 katı amonyak oluştuğuna dikkat edil-
melidir. Tepkimede, 5 mol azot kullanılırsa 15 mol hidrojen kullanıl-
ması gerekir ve sonuçta 10 mol amonyak elde edilir (Kullanılan azot
miktarı 5 kat artırılınca kullanılan hidrojenin ve oluşan amonyağın da
aynı oranda arttığına dikkat edilmelidir.).
Hacim olarak incelendiğinde N 2 , H 2 , NH 3 arasında yine 1, 3, 2 ora-
nının olduğu görülmektedir. Aynı koşullar altında tepkimede 2 litre N
2
varsa 6 litre H kullanılır ve tepkime sonucu 4 litre NH 3 elde edilir.
2
70