Page 17 - Kimya 11 | 1.Ünite
P. 17
Modern Atom Teorisi
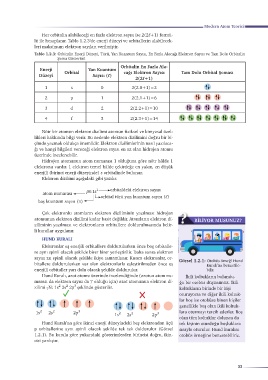
Her orbitalin alabileceği en fazla elektron sayısı ise 2(2ℓ+1) formü-
lü ile hesaplanır. Tablo 1.2.3'de enerji düzeyi ve orbitallerin alabilecek-
leri maksimum elektron sayıları verilmiştir.
Tablo 1.2.3: Orbitalin Enerji Düzeyi, Türü, Yan Kuantum Sayısı, En Fazla Alacağı Elektron Sayısı ve Tam Dolu Orbitalin
Şema Gösterimi
Orbitalin En Fazla Ala-
Enerji Yan Kuantum
Orbital cağı Elektron Sayısı Tam Dolu Orbital Şeması
Düzeyi Sayısı (ℓ)
2(2ℓ+1)
1 s 0 2(2.0+1)=2
2 p 1 2(2.1+1)=6
3 d 2 2(2.2+1)=10
4 f 3 2(2.3+1)=14
Nötr bir atomun elektron dizilimi atomun fiziksel ve kimyasal özel-
likleri hakkında bilgi verir. Bu nedenle elektron dizilimini doğru bir bi-
çimde yazmak oldukça önemlidir. Elektron dizilimlerinin nasıl yazılaca-
ğı ve hangi bilgileri vereceği elektron sayısı en az olan hidrojen atomu
üzerinde incelenebilir.
Hidrojen atomunun atom numarası 1 olduğuna göre nötr hâlde 1
elektronu vardır. 1 elektron temel hâlde çekirdeğe en yakın, en düşük
enerjili (birinci enerji düzeyinde) s orbitalinde bulunur.
Elektron dizilimi aşağıdaki gibi yazılır.
H:1s 1 orbitaldeki elektron sayısı
atom numarası 1
orbital türü yan kuantum sayısı (ℓ)
baş kuantum sayısı (n)
Çok elektronlu atomların elektron diziliminin yazılması hidrojen
atomunun elektron dizilimi kadar basit değildir. Atomların elektron di- BİLİYOR MUSUNUZ?
ziliminin yazılması ve elektronların orbitallere doldurulmasında belir-
li kurallar uygulanır.
HUND KURALI
Elektronlar eş enerjili orbitallere doldurulurken önce boş orbitalle-
re aynı spinli olacak şekilde birer birer yerleştirilir. Daha sonra elektron
sayısı zıt spinli olacak şekilde ikiye tamamlanır. Kısaca elektronlar, or-
Görsel 1.2.1: Otobüs örneği Hund
bitallere doldurulurken var olan elektronlarla eşleştirilmeden önce eş Kuralı’na benzetile-
enerjili orbitaller yarı dolu olacak şekilde doldurulur. bilir.
Hund Kuralı, azot atomu üzerinde incelendiğinde (azotun atom nu- İkili koltukların bulundu-
marası da elektron sayısı da 7 olduğu için) azot atomunun elektron di- ğu bir otobüs düşününüz. İkili
2 2 3
zilimi N: 1s 2s 2p şeklinde gösterilir. koltukların birinde bir kişi
7
oturuyorsa ve diğer ikili koltuk-
lar boş ise otobüse binen kişiler
genellikle boş olan ikili koltuk-
1s 2 2s 2 2p 3 2 2 3 lara oturmayı tercih ederler. Boş
1s 2s 2p
olan tüm koltuklar dolunca da
Hund Kuralıʼna göre ikinci enerji düzeyindeki beş elektrondan üçü tek kişinin oturduğu boşluklara
p orbitallerine aynı spinli olacak şekilde tek tek doldurulur (Görsel sırayla oturulur. Hund kuralını
1.2.1). Bu kurala göre yukarıdaki gösterimlerden birincisi doğru, ikin- otobüs örneğine benzetebiliriz.
cisi yanlıştır.
33