Page 12 - Kimya 11 | 1.Ünite
P. 12
Modern Atom Teorisi
f Orbitalleri
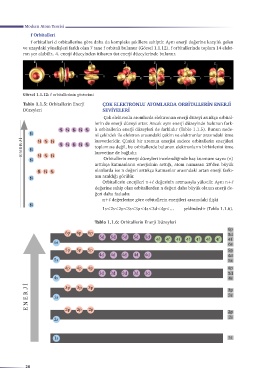
f orbitalleri d orbitallerine göre daha da kompleks şekillere sahiptir. Aynı enerji değerine karşılık gelen
ve uzaydaki yönelişleri farklı olan 7 tane f orbitali bulunur (Görsel 1.1.12). f orbitallerinde toplam 14 elekt-
ron yer alabilir.. 4. enerji düzeyinden itibaren üst enerji düzeylerinde bulunur.
Görsel 1.1.12: f orbitallerinin gösterimi
Tablo 1.1.5: Orbitallerin Enerji ÇOK ELEKTRONLU ATOMLARDA ORBİTALLERİN ENERJİ
Düzeyleri SEVİYELERİ
Çok elektronlu atomlarda elektronun enerji düzeyi arttıkça orbital-
lerin de enerji düzeyi artar. Ancak aynı enerji düzeyinde bulunan fark-
lı orbitallerin enerji düzeyleri de farklıdır (Tablo 1.1.5). Bunun nede-
ni çekirdek ile elektron arasındaki çekim ve elektronlar arasındaki itme
E N E R J İ toplamına değil, bu orbitallerde bulunan elektronların birbirlerini itme
kuvvetleridir. Çünkü bir atomun enerjisi sadece orbitallerin enerjileri
kuvvetine de bağlıdır.
Orbitallerin enerji düzeyleri incelendiğinde baş kuantum sayısı (n)
arttıkça katmanların enerjisinin arttığı, atom numarası 20’den büyük
olanlarda ise n değeri arttıkça katmanlar arasındaki artan enerji farkı-
nın azaldığı görülür.
Orbitallerin enerjileri n+ℓ değerinin artmasıyla yükselir. Aynı n+ℓ
değerine sahip olan orbitallerden n değeri daha büyük olanın enerji de-
ğeri daha fazladır.
n+ℓ değerlerine göre orbitallerin enerjileri arasındaki ilişki
1s<2s<2p<3s<3p<4s<3d<4p<… şeklindedir (Tablo 1.1.6).
Tablo 1.1.6: Orbitallerin Enerji Düzeyleri
6p
6p 6p 6p 5d
5d 5d 5d 5d 5d
4f 4f 4f 4f 4f 4f 4f 4f
6s
6s
5p 5p 5p 5p
4d 4d 4d 4d 4d 4d
5s 5s
4p 4p 4p 4p
3d 3d 3d 3d 3d 3d
4s 4s
E N E R J İ 3s 3p 3p 3p 3p
3s
2p
2p
2p
2p
2s
2s
1s 1s
28