Page 20 - Kimya 11 | 4.Ünite
P. 20
Kimyasal Tepkimelerde Enerji
Bir bağın koparılması için gereken enerji ne kadar büyükse bağ o
kadar sağlamdır. Ayrıca bağ uzunluğu ne kadar kısa ise bağ da o kadar
sağlamdır. Bağ uzunluğu kovalent bağ yapan iki atomun çekirdekleri
arasındaki uzaklıktır. Paylaşılan elektron çifti sayısı arttıkça bağ uzun-
luğu kısalır, bağ kuvveti artar. Bu nedenle üçlü bağlar ikili bağlardan,
ikili bağlar da tekli bağlardan daha kısa ve sağlamdır. Örneğin flor mo-
leküllerini atomlarına ayırmak için mol başına 154 kj enerji gerekirken
oksijen moleküllerini atomlarına ayırmak için mol başına 498 kj enerji
gerekir. Azot moleküllerini atomlarına ayırmak ise daha zordur ve mol
başına 941 kj enerji gerekir.
F−F(g)+154 kj F(g)+F(g) F(g)+F(g) F (g)+154 kj
2
O=O(g)+498 kj O(g)+O(g) O(g)+O(g) O (g)+498 kj
2
N / N(g)+941 kj N(g)+N(g) N(g)+N(g) N (g)+941 kj
2
Bağ enerjisi ve bağ uzunluğu atomun büyüklüğü, elektronegatiflik
ve molekülün yapısı gibi birçok faktöre bağlıdır. Bu nedenle bağ ener-
jisi aynı iki atom arasında olmasına rağmen moleküller farklı olduğun-
da bağ enerjileri de farklı olur. Örneğin C-H bağının kırılmasında gere-
ken enerji miktarı CH ve C H moleküllerinde farklı değerdedir. C-H
6
4
2
bağının bağ enerjileri hesaplanırken mümkün olduğu kadar çok sayıda
bileşikten elde edilen değerlerin ortalaması alınarak hesaplanır. Tablo
4.3.1ʼde bağların ortalama enerjileri verilmiştir.
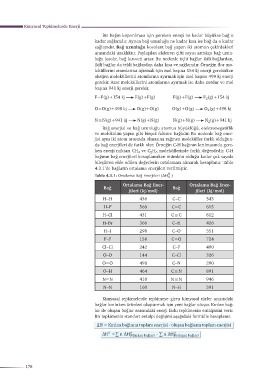
0
Tablo 4.3.1: Ortalama Bağ Enerjileri (ΔH )
B
Ortalama Bağ Ener- Ortalama Bağ Ener-
Bağ Bağ
jileri (kj/mol) jileri (kj/mol)
H–H 436 C–C 343
H–F 568 C=C 615
H–Cl 431 C / C 812
H–Br 366 C–H 416
H–I 298 C–O 351
F–F 158 C=O 724
Cl–Cl 242 C–F 490
O–O 144 C–Cl 326
O=O 498 C–N 290
O–H 464 C / N 891
N=N 418 N / N 946
N–N 160 N–H 391
Kimyasal tepkimelerde tepkimeye giren kimyasal türler arasındaki
bağlar kırılırken ürünleri oluşturmak için yeni bağlar oluşur. Kırılan bağ-
lar ile oluşan bağlar arasındaki enerji farkı tepkimenin entalpisini verir.
Bir tepkimenin standart entalpi değişimi aşağıdaki formülle hesaplanır.
∆H = Kırılan bağların toplam enerjisi - oluşan bağların toplam enerjisi
o
o
o
ΔH =∑ n ΔH B(kırılan bağlar) - ∑ n ΔH B(oluşan bağlar)
178