Page 26 - Kimya 12 | 2.Ünite
P. 26
2. ÜNITE: KARBON KIMYASINA GIRIŞ
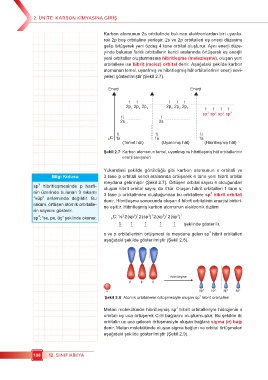
Karbon atomunun 2s orbitalinde bulunan elektronlardan biri uyarıla-
rak 2p boş orbitaline yerleşir. 2s ve 2p orbitalleri eş enerji düzeyine
gelip örtüşerek yeni özdeş 4 tane orbital oluşturur. Aynı enerji düze-
yinde bulunan farklı orbitallerin kendi aralarında örtüşerek eş enerjili
yeni orbitaller oluşturmasına hibritleşme (melezleşme), oluşan yeni
orbitallere ise hibrit (melez) orbital denir. Aşağıdaki şekilde karbon
atomunun temel, uyarılmış ve hibritleşmiş hâl orbitallerinin enerji sevi-
yeleri gösterilmiştir (Şekil 2.7).
Enerji Enerji
- - - - -
2 p 2 p 2 p z 2 p 2 p 2 p z - - - -
x
y
y
x
3
3
3
sp sp sp sp 3
-. -
2 s 2 s
-. -. -.
C 1 s 1 s 1 s
6
(Temel hâl) (Uyarılmış hâl) (Hibritleşmiş hâl)
Şekil 2.7: Karbon atomunun temel, uyarılmış ve hibritleşmiş hâl orbitallerinin
enerji seviyeleri
Yukarıdaki şekilde görüldüğü gibi karbon atomunun s orbitali ve
Bilgi Kutusu 3 tane p orbitali kendi aralarında örtüşerek 4 tane yeni hibrit orbital
meydana getirmiştir (Şekil 2.7). Örtüşen orbital sayısı 4 olduğundan
3
sp hibritleşmesinde p harfi- oluşan hibrit orbital sayısı da 4’tür. Oluşan hibrit orbitalleri 1 tane s,
nin üzerinde bulunan 3 rakamı 3 tane p orbitalinden oluştuğundan bu orbitallere sp hibrit orbitali
3
“küp” anlamında değildir. Bu denir. Hibritleşme sonucunda oluşan 4 hibrit orbitalinin enerjisi birbiri-
rakam, örtüşen atomik orbitalle- ne eşittir. Hibritleşmiş karbon atomunun elektronik dizilimi
rin sayısını gösterir.
) 2
2
) 2
)
:
) 2
3
sp ; “se, pe, üç” şeklinde okunur. 6 Cs12 (sp 3 1 (sp 3 1 (sp 3 1 (sp 3 1
-. - - - - şeklinde gösterilir.
3
s ve p orbitallerinin örtüşmesi ile meydana gelen sp hibrit orbitalleri
aşağıdaki şekilde gösterilmiştir (Şekil 2.8).
hibritleşme
p p p
s sp 3 sp 3 sp 3 sp 3
3
Şekil 2.8: Atomik orbitallerin örtüşmesiyle oluşan sp hibrit orbitalleri
3
Metan molekülünde hibritleşmiş sp hibrit orbitalleriyle hidrojenin s
orbitali uç uca örtüşerek C-H bağlarını oluşturmuştur. Bu şekilde iki
orbitalin uç uca gelerek örtüşmesiyle oluşan bağlara sigma (σ) bağı
denir. Metan molekülünde oluşan sigma bağları ve orbital örtüşmeleri
aşağıdaki şekilde gösterilmiştir (Şekil 2.9).
108 12. SINIF KIMYA