Page 30 - Kimya 12 | 2.Ünite
P. 30
2. ÜNITE: KARBON KIMYASINA GIRIŞ
Asetilen molekülünde C atomları arasındaki bağlardan biri sigma, diğer
ikisi pi bağıdır. Bu molekül oluşurken C atomunun 2s orbitaliyle p orbi-
x
tali hibritleşerek sp hibrit orbitallerini oluşturur. Hibritleşmeye katılma-
yan p ve p orbitalleri ise pi bağlarını oluşturur. Karbon atomunun sp
y
z
hibrit orbitallerinin enerji seviyeleri aşağıda gösterilmiştir (Şekil 2.16):
Enerji
- - - - - - -
2 p 2 p 2 p z 2 p 2 p 2 p z 2 p 2 p z
x
x
y
y
y
- -
-. - sp sp
2 s 2 s
-. -. -.
C 1 s 1 s 1 s
6
(Temel hâl) (Uyarılmış hâl) (Hibritleşmiş hâl)
Şekil 2.16: Karbon atomunun temel, uyarılmış ve hibritleşmiş hâl orbitalleri-
nin enerji seviyeleri
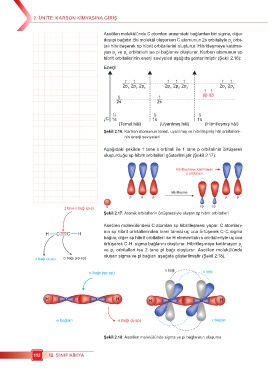
Aşağıdaki şekilde 1 tane s orbitali ile 1 tane p orbitalinin örtüşerek
oluşturduğu sp hibrit orbitalleri gösterilmiştir (Şekil 2.17).
Hibritleşmeye katılmayan
p orbitalleri
hibritleşme
p p p p p
2 tane π bağı (p-p) s sp sp
Şekil 2.17: Atomik orbitallerin örtüşmesiyle oluşan sp hibrit orbitalleri
Asetilen molekülündeki C atomları sp hibritleşmesi yapar. C atomları-
H C C H nın sp hibrit orbitallerinden birer tanesi uç uca örtüşerek C-C sigma
bağını, diğer sp hibrit orbitalleri ise H elementinin s orbitalleriyle uç uca
örtüşerek C-H sigma bağlarını oluşturur. Hibritleşmeye katılmayan p
y
ve p orbitalleri ise 2 tane pi bağı oluşturur. Asetilen molekülünde
z
oluşan sigma ve pi bağları aşağıda gösterilmiştir (Şekil 2.18).
σ bağı (s-sp) σ bağı (sp-sp)
π bağı
σ bağı (sp-sp) π bağı
H C C H H C C H
σ bağları σ bağı (s-sp) π bağları
Şekil 2.18: Asetilen molekülünde sigma ve pi bağlarının oluşumu
112 12. SINIF KIMYA