Page 52 - Fen Lisesi Kimya 11 | 6.Ünite
P. 52
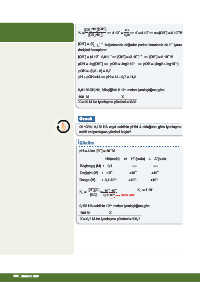
+
[CH NH ][OH¯] x.x
3
3
6
2
4
3
K = ⇒ 4.10¯ = ⇒ x = 4.10¯ ⇒ x= [OH¯] = 2.10¯ M
b
[CH NH ] 0,01
3 2
+
1/2
[OH¯] = (K c ) bağıntısında değerler yerine konularak da H iyonu
b b
derişimi hesaplanır.
-
-6
3
-6 1/2
[OH¯] = (4.10 .0,01) ⇒ [OH¯] = (4.10 ) ⇒ [OH ] = 2.10¯ M
1/2
3
3
pOH = -log[OH¯] ⇒ pOH = -log2.10¯ ⇒ pOH = -(log2 + log10¯ )
pOH = -(0,3 - 3) = 2,7
pH + pOH =14 ⇒ pH = 14 - 2,7 = 11,3
-3
0,01 M CH NH bileşiğinin 2.10 moları iyonlaştığına göre
3 2
100 M X
X = 20 M ise iyonlaşma yüzdesi = %20
Örnek
o
25 C’de 0,1M HA zayıf asidinin pH’si 4 olduğuna göre iyonlaşma
sabiti ve iyonlaşma yüzdesi kaçtır?
Çözüm
4
+
pH = 4 ise [H ] = 10¯ M
+
HA(suda) ⇌ H (suda) + A¯(suda)
Başlangıç (M) : 0,1 ---- ----
4
4
Değişim (M) : -10¯ +10¯ +10¯ 4
4
4
Denge (M) : 0,1-10¯ +10¯ +10¯ 4
+ 7
[H ][A¯] 10¯ .10¯ 4 K = 1.10¯
4
K = = a
a [HA] 0,1-10¯ 4 İhmal edilir.
4
0,1M HA asidinin 10¯ moları iyonlaştığına göre
100 M X
X = 0,1 M ise iyonlaşma yüzdesi = %0,1
360 KİMYA 11. SINIF