Page 47 - Fen Lisesi Kimya 11 | 6.Ünite
P. 47
KiMYASAL TEPKiMELERDE DENGE
6.16. Alıştırma
Aşağıda verilen zayıf asitlerin K değerlerinden yararlanarak konjuge
a
bazların (HCOO¯ ve CN¯) bazlık değerlerini karşılaştırınız.
4
HCOOH için K = 1,7.10¯ HCN için K = 4,9.10¯ 10
a a
İyonlaşma Yüzdesi
K değerinin büyüklüğü bir asidin kuvveti hakkında bilgi verir. Asidin
a
kuvveti için diğer bir bilgi iyonlaşma yüzdesinin hesaplanması ile elde
edilir.
İyonlaşan asidin dengedeki derişimi
İyonlaşma yüzdesi = .100
Asidin başlangıç derişimi
Asidin kuvveti arttıkça iyonlaşma yüzdesi de artar. Tek protonlu HA
+
asidi için iyonlaşan asit derişimi, dengedeki A¯ iyonlarının ya da H iyon-
larının derişimine eşittir. Buna göre iyonlaşma yüzdesi
+
[H ]
İyonlaşma yüzdesi = .100 şeklinde hesaplanır.
[HA]
+
Burada [H ], dengedeki derişim ve [HA] başlangıç derişimidir.
Zayıf bir asidin iyonlaşma derecesi, asidin başlangıç derişimine bağ-
lıdır. Çözelti seyreldikçe iyonlaşma yüzdesi artar. Bir asit seyreltildiğin-
de birim hacim başına taneciklerin sayısı başlangıçtakine göre azalır.
Le Chatelier İlkesi’ne göre bu seyrelme etkisini karşılamak için denge,
+
iyonlaşmamış asitten daha çok tanecik (iyon) oluşturmak üzere H ve
konjuge baz yönüne kayar. Kuvvetli asitlerde iyonlaşma yüzdesi baş-
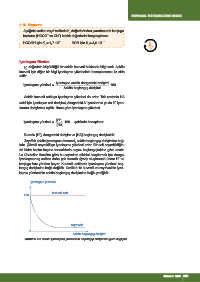
langıç derişimine bağlı değildir. Grafik 6.16 kuvvetli ve zayıf asidin iyon-
laşma yüzdesinin asidin başlangıç derişimine bağlı grafiğidir.
İyonlaşma yüzdesi
kuvvetli asit
100
zayıf asit
0
Asidin başlangıç derişimi
Grafik 6.16: Asidin iyonlaşma yüzdesinin başlangıç derişimine göre değişimi
355
KİMYA 11. SINIF