Page 149 - KİMYA-11
P. 149
Ortaöğretim Genel Müdürlüğü KİMYA 11
CEVAP ANAHTARLARI
Etkinlik No.: 5
1. Yönerge
7N: [He]2s22p3 1. Metallerin oksitleri su ile tepkimeye girerek baz oluştururlar ve ortama
OH- iyonu verirler. Periyodik sistemde metaller sol tarafta bulunmaktadır.
Bu yüzden soldan sağa doğru metalik özellik azalacağından bazik karak-
terde azalacaktır. Bu önerme doğru olduğu için atom yarıçapı büyük olan
K seçilmelidir. İkinci önermeye göre atomlar periyodik sistemde sıralan-
19
dığında atom numarası sıralanışı doğru olmaktadır. Dolayısıyla burada
8O: [He]2s22p⁴ da atom yarıçapı büyük olan Al seçilmelidir. P’ nin birinci iyonlaşma
15
13
enerjisi küresel simetri özelliğinden dolayı S’ den daha büyük olmalıydı.
16
Bu önerme yanlış olduğu için yarıçapı küçük olan Na seçilmeli ve
+
11
ARGON ÇIKIŞI’ na ulaşılmalıdır.
2. Yönerge
1. K ve Na atomları aynı grupta (1A) bulunmaktadır. Aynı grupta yukarıdan
9F: [He]2s22p⁵ aşağıya doğru inildikçe enerji düzeyleri artar. Dolayısıyla atom yarıçapı
da artar. K atomunun yarıçapı Na atomunun yarıçapından daha büyüktür.
2. Kükürt (S) atomunun elektron dizilimi 3p4 ile biterken, Fosfor (P) atomu-
nun elektron dizilimine baktığımızda 3p3 ile bittiğini gözlemleriz. Bu fos-
for atomunun küresel simetri özelliği gösterdiği anlamına gelir. Küresel
simetri özelliği gösteren atomlar göstermeyenlere göre daha kararlıdır. Bu
yüzden bu atomlardan elektron koparmak daha zor olacağı için fosforun
10Ne: [He]2s22p⁶ birinci iyonlaşma enerjisi kükürtten büyük olmalıdır.
3. Sodyum (Na) atomu elektron verdikçe elektron sayısı azalacak ancak
çekirdek yükü değişmeyecektir. Bu durumda elektron başına düşen çekim
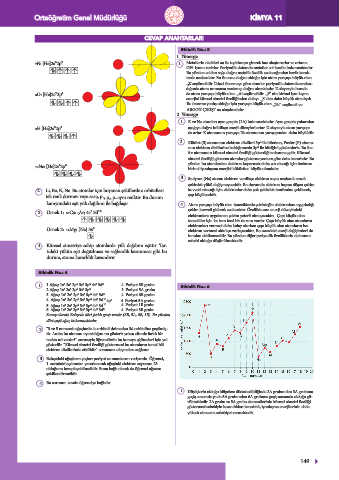
2. Li, Be, N, Ne. Bu atomlar için boyanan şekillerde s orbitalleri kuvveti artacağı için elektronlar daha çok çekirdek tarafından çekilecek,
çap küçülecektir.
tek renk (kırmızı veya sarı), px, py, pz aynı renktir. Bu durum
kamyondaki eşit yük dağılımı ile bağdaşır. 4. Atom yarıçapı büyük olan taneciklerde çekirdeğin elektronlara uyguladığı
çekim kuvveti giderek azalacaktır. Özellikle son enerji düzeyindeki
3. Örnek 1: 29Cu: (Ar) 4s1 3d1⁰ elektronlara uygulanan çekim yeterli olmayacaktır. Çapı küçük olan
tanecikler için ise tam tersi bir durum vardır. Çapı büyük olan atomların
elektronları vermesi daha kolay olurken çapı küçük olan atomların ise
Örnek 2: 12Mg: [Ne] 3s2 elektron vermesi oldukça zorlaşacaktır. Bu esnadaki enerji değişimleri de
bundan etkilenecektir. Bu yüzden diğer periyodik özelliklerin de bunun
sebebi olduğu düşünülmektedir.
4. Küresel simetriye sahip atomlarda yük dağılımı eşittir. Tar-
tıdaki yükün eşit dağıtılması ve sağlamlık kazanması gibi bu
durum, atoma kararlılık kazandırır.
Etkinlik No.: 4
1. 1.Ağaç: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 4. Periyot 8B grubu Etkinlik No.: 6
2.Ağaç: 1s2 2s2 2p6 3s2 3p3 3. Periyot 5A grubu
3. Ağaç: 1s2 2s2 2p6 3s2 3p6 4s1 3d5 4. Periyot 6B grubu
4. Ağaç: 1s2 2s2 2p6 3s2 3p6 4s2 3d 4p3 4. Periyot 5A grubu
10
5. Ağaç: 1s2 2s2 2p6 3s2 3p6 4s1 3d 4. Periyot 1B grubu
10
6. Ağaç: 1s2 2s2 2p6 3s2 3p6 4s2 3d8 4. Periyot 8B grubu
Sonuç olarak: Bahçede dört farklı grup vardır (8B, 5A, 6B, 1B). Bu yüzden
dört çeşit ağaç bulunmaktadır.
2. “3 ve 5 numaralı ağaçlarda 4s orbitali dolmadan 3d orbitaline geçilmiş-
tir. Acaba bu atomun uyarıldığını mı gösterir yoksa altında farklı bir
neden mi vardır?” sorusuyla öğrencilerin bu konuya eğilmeleri için yol
gösterilir. “Küresel simetri özelliği göstermesi bu atomların temel hâl
elektron diziliminde etkilidir.” sonucuna ulaşmaları sağlanır.
3. Bahçedeki ağaçların yaşları periyot numaralarını veriyordu. Öğrenci,
1. sorudaki açılımdan yararlanarak ağaçtaki elektron sayısının 23
olduğunu hesaplayabilmelidir. Buna bağlı olarak da öğrenci ağacını
şekillendirmelidir.
4. Bu sorunun cevabı öğrenciye bağlıdır.
1. Düşüşlerin olduğu bölgelere dikkat edildiğinde 2A grubundan 3A grubuna
geçiş sırasında ya da 5A grubundan 6A grubuna geçiş sırasında olduğu gö-
rülmektedir. 2A grubu ve 5A grubu elementlerinin küresel simetri özelliği
göstermesi sebebiyle kazandıkları kararlılık, iyonlaşma enerjilerinin daha
yüksek olmasına sebebiyet vermektedir.
149