Page 150 - KİMYA-11
P. 150
KİMYA 11 Ortaöğretim Genel Müdürlüğü
CEVAP ANAHTARLARI
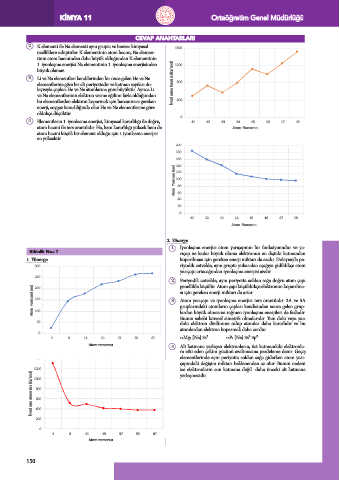
2. K elementi ile Na elementi aynı grupta ve benzer kimyasal 1600
özelliklere sahiptirler. K elementinin atom hacmi, Na elemen-
tinin atom hacminden daha büyük olduğundan K elementinin
1. iyonlaşma enerjisi Na elementinin 1. iyonlaşma enerjisinden 1200
büyük olamaz.
3. Li ve Na elementleri kendilerinden bir önce gelen He ve Ne
elementlerine göre bir alt periyottadır ve katman sayıları do- İyonlaşma Enerjisi (kj/mol) 800
layısıyla çapları He ve Ne atomlarına göre büyüktür. Ayrıca Li
ve Na elementlerinin elektron verme eğilimi fazla olduğundan
bu elementlerden elektron koparmak için harcanması gereken 400
enerji, soygaz kararlılığında olan He ve Ne elementlerine göre
oldukça düşüktür.
4. Elementlerin 1. iyonlasma enerjisi, kimyasal kararlılığı ile doğru, 0 11 12 13 14 15 16 17 18
atom hacmi ile ters orantılıdır. He, hem kararlılığı yüksek hem de Atom Numarası
atom hacmi küçük bir element olduğu için 1.iyonlasma enerjisi
en yüksektir.
200
180
160
140
Atom Yarıçapı (pm) 120
100
80
60
40
20
0
11 12 13 14 15 16 17 18
Atom Numarası
2. Yönerge
1. İyonlaşma enerjisi atom yarıçapının bir fonksiyonudur ve ya-
Etkinlik No.: 7 rıçap ne kadar büyük olursa elektronun en dıştaki katmandan
1. Yönerge koparılması için gereken enerji miktarı da azalır. Dolayısıyla pe-
300 riyodik cetvelde, aynı grupta yukarıdan aşağıya gidildikçe atom
yarıçapı artacağından iyonlaşma enerjisi azalır.
250
2. Periyodik cetvelde, aynı periyotta soldan sağa doğru atom çapı
genellikle küçülür. Atom çapı küçüldükçe elektronun koparılma-
Atom yarıçapı (pm) 150 3. sı için gereken enerji miktarı da artar.
200
Atom yarıçapı ve iyonlaşma enerjisi ters orantılıdır. 2A ve 5A
gruplarındaki atomların çapları kendisinden sonra gelen grup-
100
lardan büyük olmasına rağmen iyonlaşma enerjileri de fazladır.
Bunun sebebi küresel simetrik olmalarıdır. Tam dolu veya yarı
50 dolu elektron dizilimine sahip atomlar daha kararlıdır ve bu
atomlardan elektron koparmak daha zordur.
0
1 3 11 19 37 55 87 12Mg: [Ne] 3s2 15P: [Ne] 3s2 3p3
Aton numarası
Atom numarası 4. Alt katmana yerleşen elektronların, üst katmandaki elektronla-
ra etki eden çekim gücünü azaltmasına perdeleme denir. Geçiş
1400 elementlerinde aynı periyotta soldan sağa giderken atom yarı-
çapındaki değişim miktarı beklenenden az olur. Bunun nedeni
1200 ise elektronların son katmana değil daha önceki alt katmana
İyonlaşma Enerjisi (kj/mol) 800
yerleşmesidir.
1000
600
400
200
0
1 3 11 19 37 55 87
Aton numarası
Atom numarası
150