Page 10 - Fen Lisesi Kimya 11
P. 10
1.1. Alıştırma
Kuantum Kuramı’na göre, aşağıda baş kuantum sayısı verilen orbital türlerinden hangileri olabilir?
a) 2s b) 3f c) 1p ç) 2d d) 4d e) 4f
1.2. Alıştırma
Aşağıda verilen kuantum sayıları (n, ℓ, m , m ) dizilerinden yanlış olanları belirleyiniz ve neden yanlış
ℓ s
olduğunu açıklayınız.
a) 2, -1, -1, +1/2 b) 3, 1, +1, -1/2 c) 1, 0, 0, +1/2
ç) 2, 2, +1, -1/2 d) 3, 2, -2, 0
Orbital Çeşitleri
Atomik orbitallerin özellikleri incelenirken karşılaşılan en önemli so-
run “Orbitallerin şekilleri nasıldır?” sorusudur. Orbitaller tam olarak ta-
nımlanabilmiş şekillere sahip değildir. Shcrödinger’e göre bunun sebebi
orbital özelliğini gösteren dalga fonksiyonun atom çekirdeğinden itiba-
Elektronun bulunma olasılığı diğinin tam olarak ifadesi zordur. Özellikle atomlar arasındaki kimyasal
ren sonsuza kadar uzanmasıdır. Bu nedenle bir orbitalin neye benze-
bağ oluşumlarını açıklamak için orbitallerin belirli şekillere sahip olduk-
ları varsayılmıştır. Bilinen 118 element için kullanılan 4 çeşit orbital (s, p,
d, f) yeterlidir. Bu orbitallerin şekilleri aşağıda belirtilmiştir.
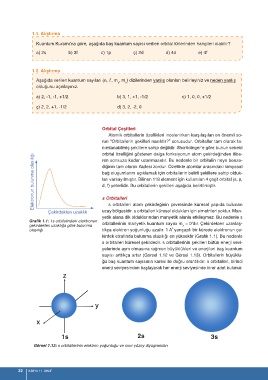
s orbitalleri atom çekirdeğinin çevresinde küresel yapıda bulunan
uzay bölgesidir. s orbitalleri küresel oldukları için simetrileri yoktur. Man-
Çekirdekten uzaklık s Orbitalleri
yetik alana dik olduklarından manyetik alanla etkileşmez. Bu nedenle s
Grafik 1.1: 1s orbitalindeki elektronun orbitallerinin manyetik kuantum sayısı m = 0’dır. Çekirdekten uzaklaş-
çekirdekten uzaklığa göre bulunma o ℓ
olasılığı tıkça elektron yoğunluğu azalır. 1 A yarıçaplı bir kürede elektronun çe-
kirdek etrafında bulunma olasılığı en yüksektir (Grafik 1.1). Bu nedenle
s orbitalleri küresel şekildedir. s orbitallerinin şekilleri bütün enerji sevi-
yelerinde aynı olmasına rağmen büyüklükleri ve enerjileri baş kuantum
sayısı arttıkça artar (Görsel 1.12 ve Görsel 1.13). Orbitallerin büyüklü-
ğü baş kuantum sayısının karesi ile doğru orantılıdır. s orbitalleri, birinci
enerji seviyesinden başlayarak her enerji seviyesinde birer adet bulunur.
1s 2s 3s
Görsel 1.12: s orbitallerinin elektron yoğunluğu ve sınır yüzey diyagramları
22 KİMYA 11. SINIF