Page 42 - Fen Lisesi Kimya 11
P. 42
Oksit ve Hidroksit Bileşiklerinin Asitlik/Bazlık Eğilimleri
Periyodik sistemdeki elementlerin asitlik ve bazlık karakterleri oksit
ve hidroksit bileşikleri üzerinden incelenir. Ametallerin oksit ve hidroksit
bileşikleri genellikle asidik özellik gösterirken metallerin oksit ve hidrok-
sit bileşikleri genellikle bazik özellik gösterir.
Na O, K O, CaO, MgO, SrO, BaO, FeO, Fe O , CuO, Cu O … gibi me-
2 2 2 3 2
tal oksitler bazik özellik gösterir. Bazik oksitler, su ile etkileştiklerinde
baz oluşturur ve oluşan baz suda iyonlaşarak suya hidroksit (OH¯) iyo-
nu verir.
Na O(k) + H O(s) → 2NaOH(suda)
2 2
Oluşan NaOH suda
+
NaOH(suda) → Na (suda) + OH¯(suda) şeklinde iyonlaşarak bazik çö-
zelti oluşturur.
CaO(k) + H O(s) → Ca(OH) (suda)
2 2
Oluşan Ca(OH) suda
2
2+
Ca(OH) (suda) → Ca (suda) + 2OH¯(suda) şeklinde iyonlaşarak bazik
2
çözelti oluşturur.
Periyodik sistemde grupta yukarıdan aşağı inildikçe elementlerin
hidroksit bileşiklerinin bazlık kuvveti artar. Bu bileşiklerde hidroksit gru-
-
bunun (OH ) bağlı olduğu merkez atomun atom yarıçapı artarken elekt-
ronegatifliği azalır. Merkez atom O – H bağındaki elektronları zayıf
kuvvetle çektiği için O – H bağında kopma olmaz, metal – OH arasın-
daki etkileşim bozularak hidroksit iyonu açığa çıkar. Bu nedenle metalin
elektronegatifliği azaldıkça – OH vermesi kolaylaşarak bazlık kuvveti
artar.
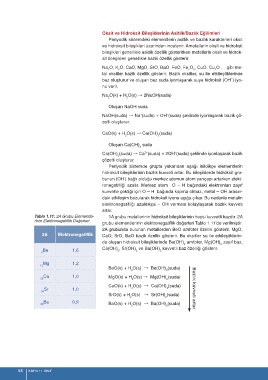
Tablo 1.11: 2A Grubu Elementle- 1A grubu metallerinin hidroksit bileşiklerinin hepsi kuvvetli bazdır. 2A
rinin Elektronegatiflik Değerleri
grubu elementlerinin elektronegatiflik değerleri Tablo 1.11’de verilmiştir.
2A grubunda bulunan metallerden BeO amfoter özellik gösterir. MgO,
2A Elektronegatiflik CaO, SrO, BaO bazik özellik gösterir. Bu oksitler su ile etkileştiklerin-
de oluşan hidroksit bileşiklerinde Be(OH) amfoter, Mg(OH) zayıf baz,
2 2
Ca(OH) , Sr(OH) ve Ba(OH) kuvvetli baz özelliği gösterir.
Be 1,6 2 2 2
4
Mg 1,2
12
BeO(k) + H O(s) → Be(OH) (suda)
2 2
Ca 1,0 MgO(k) + H O(s) → Mg(OH) (suda)
20 2 2
CaO(k) + H O(s) → Ca(OH) (suda)
Sr 1,0 2 2 Bazlık kuvveti artar.
38
SrO(k) + H O(s) → Sr(OH) (suda)
2 2
Ba 0,9
56 BaO(k) + H O(s) → Ba(OH) (suda)
2 2
54 KİMYA 11. SINIF