Page 40 - Fen Lisesi Kimya 11
P. 40
Örnek
Gaz hâlindeki X ve Y atomlarına 1 elektron verildiğinde açığa çıkan enerji miktarı X < Y şeklinde olduğuna
göre X ve Y atomlarından hangisinin elektron ilgisi daha fazladır?
Çözüm
Elektron ilgisi, nötr bir atoma 1 elektron ilave edilme sırasındaki enerji değişimidir. Bir atom, elektron
aldığında ne kadar fazla enerji açığa çıkarsa atomun elektron ilgisi o kadar fazladır. Buna göre elektron
ilgisi X < Y şeklindedir.
1.10. Alıştırma
Periyodik sistemde üçüncü periyotta bulunan atomlardan X metal, Y ametal ve Z soy gaz olduğuna
göre X, Y ve Z’nin elektron ilgilerini karşılaştırınız.
Elektronegatiflik
Bir atomun bağ yapan elektronlarını kendine çekme yeteneğine
(atomun bağ elektronlarına sahip çıkma isteğine) elektronegatiflik de-
nir. Elektronegatiflik iyonlaşma enerjisi, elektron ilgisine bağlı bir büyük-
lüktür ve doğrudan ölçülemez. Elektronegatiflik değerleri elektron ilgisi
ve iyonlaşma enerjisi değerlerinden hesaplanır.
Periyodik sistemde periyotlarda soldan sağa gidildikçe elektronega-
tiflik genellikle artarken gruplarda yukarıdan aşağı inildikçe genellikle
azalır. Elektronegatiflik değerleri birçok maddenin yapı ve özelliklerinin
anlaşılmasına yardımcı olur. Örneğin bileşiklerdeki oluşan bağların polar
ya da apolar olduğu bağı oluşturan atomların elektronegatiflik farkına ba-
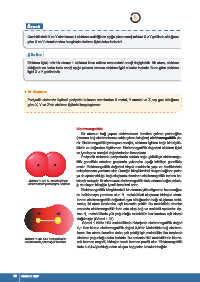
Görsel 1.27: H molekülünün kılarak anlaşılır. İki atom arası elektronegatiflik farkı artarsa bağın polarlı-
2
elektrostatik potansiyel haritası
ğı ve oluşan bileşiğin iyonik karakteri artar.
Elektronegatiflik bileşiklerdeki bir atomun yükseltgenme basamağını
da belirlemeye yardımcı olur. H molekülünü oluşturan hidrojen atom-
2
larının elektronegatiflik değerleri aynı olduğundan bağı oluşturan elekt-
ronlar, iki atom tarafından eşit kuvvetle çekilir. Bu molekülde atomlar
arasında elektronegatiflik farkı sıfır olup bağ ve molekül apolardır. Ay-
+
H CI¯ rıca H molekülünde yük yoğunluğu molekülün her tarafına eşit olarak
2
dağılmıştır (Görsel 1.27).
Görsel 1.28’de HCI molekülünde hidrojenin elektronegatiflik değeri
2,1 iken klorun elektronegatiflik değeri 3,0’dır. Molekülde bağ elektron-
larını klor atomu kendine daha çok çektiği için molekülün klor tarafında
elektron yoğunluğu daha fazladır. Bu nedenle HCI molekülünün klor ta-
Görsel 1.28: HCI molekülünün
elektrostatik potansiyel haritası rafı kısmen negatif, hidrojen tarafı kısmen pozitif olur. Elektronegatiflik
farkı 3 - 2,1 = 0,9 olduğundan oluşan bağ polar kovalent bağdır.
52 KİMYA 11. SINIF