Page 39 - Fen Lisesi Kimya 11
P. 39
MODERN ATOM TEORİSİ
F(g) + e¯ → F¯(g) + 328 kJ Eİ= -328 kJ/mol
Cl(g) + e¯ → Cl¯(g) + 349 kJ Eİ= -349 kJ/mol
N(g) + e¯ + 7 kJ → N¯(g) Eİ= +7 kJ/mol
Atomların elektron ilgileri için daha büyük ya da daha küçük gibi
kullanılan ifadeler bir elektron kazanmaya karşı yüksek ilgisini kastet-
mektedir. Düşük elektron ilgisi değeri, küçük negatif değer olarak belir-
tilir. Periyodik sistemde elektron ilgisi en büyük element klordur. Klor,
1 elektron aldığında dışarıya 349 kJ/mol enerji açığa çıkarken flor 1
elektron aldığında dışarıya 328 kJ/mol enerji açığa çıkar.
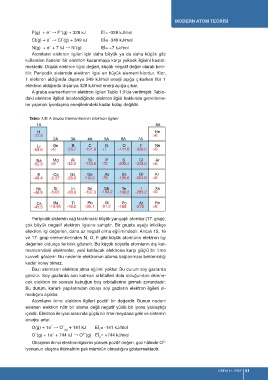
A grubu elementlerinin elektron ilgileri Tablo 1.9’da verilmiştir. Tablo-
daki elektron ilgileri incelendiğinde elektron ilgisi hakkında genelleme-
ler yapmak iyonlaşma enerjilerindeki kadar kolay değildir.
Tablo 1.9: A Grubu Elementlerinin Elektron İlgileri
Periyodik sistemin sağ tarafındaki küçük yarıçaplı atomlar (17. grup),
çok büyük negatif elektron ilgisine sahiptir. Bir grupta aşağı inildikçe
elektron ilgi değerleri, daha az negatif olma eğilimindedir. Ancak 15, 16
ve 17. grup elementlerinden N, O, F gibi küçük atomların elektron ilgi
değerleri oldukça farklılık gösterir. Bu küçük boyutlu atomların dış kat-
manlarındaki elektronlar, yeni katılacak elektrona karşı güçlü bir itme
kuvveti gösterir. Bu nedenle elektronun atoma bağlanması beklenildiği
kadar kolay olmaz.
Bazı atomların elektron alma eğilimi yoktur. Bu durum soy gazlarda
görülür. Soy gazlarda son katman orbitalleri dolu olduğundan eklene-
cek elektron bir sonraki kabuğun boş orbitallerine girmek zorundadır.
Bu durum, kararlı yapılarından dolayı soy gazların elektron ilgileri ol-
madığını açıklar.
Atomların ikinci elektron ilgileri pozitif bir değerdir. Bunun nedeni
eklenen elektron nötr bir atoma değil negatif yüklü bir iyona yaklaştığı
içindir. Elektron ile iyon arasında güçlü bir itme meydana gelir ve sistemin
enerjisi artar.
O(g) + 1e¯ → O¯ + 141 kJ Eİ = -141 kJ/mol
(g) 1
2
O¯(g) + 1e¯ + 744 kJ → O ¯(g) Eİ = +744 kJ/mol
2
2
Oksijenin ikinci elektron ilgisinin yüksek pozitif değeri, gaz hâlinde O ¯
iyonunun oluşma ihtimalinin pek mümkün olmadığını göstermektedir.
51
KİMYA 11. SINIF