Page 44 - Fen Lisesi Kimya 11
P. 44
c) Ardışık İyonlaşma Enerjilerinin Grup Numarasıyla İlişkisi
Bir elementte elektronlar aynı enerji seviyesinden sırayla ko-
parıldığında bu elektronlar için harcanan iyonlaşma enerjileri arasın-
daki artış farkı yaklaşık 1,5 ile 3 kat arasıdır. Değerlik elektronları aynı
enerji seviyesinde bulunduğundan elementlerin değerlik elektronlarını
koparmak için gerekli enerjileri arasındaki artış farkı da 1,5 ile 3 kat
arasıdır. Elementin değerlik elektronları koparıldıktan sonraki elektron bir
alt enerji seviyesinden ve soy gaz elektron düzeninden koparıldığı için
iyonlaşma enerjisinde aşırı bir artış olur. Bu aşırı artış en az 3,5 kattan
fazladır. A grubu elementleri için ardışık iyonlaşma enerjileri arasındaki
aşırı farktan yararlanarak elementin;
■ Değerlik elektron sayısı,
■ Değerliği,
■ Grup numarası,
■ Bir başka element ile yapacağı kararlı bileşik formülleri bulunabilir.
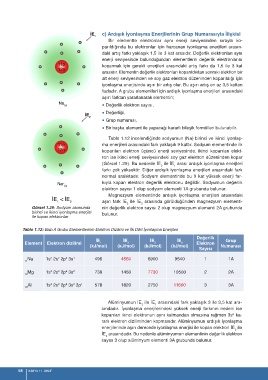
Tablo 1.12 incelendiğinde sodyumun (Na) birinci ve ikinci iyonlaş-
ma enerjileri arasındaki fark yaklaşık 9 kattır. Sodyum elementinde ilk
koparılan elektron üçüncü enerji seviyesinde, ikinci koparılan elekt-
ron ise ikinci enerji seviyesindeki soy gaz elektron düzeninden kopar
(Görsel 1.29). Bu nedenle İE ile İE arası ardışık iyonlaşma enerjleri
2 1
farkı çok yüksektir. Diğer ardışık iyonlaşma enerjileri arasındaki fark
normal aralıktadır. Sodyum elementinde bu 9 kat yüksek enerji far-
kıyla kopan elektron değerlik elektronu değildir. Sodyumun değerlik
elektron sayısı 1 olup sodyum elementi 1A grubunda bulunur.
Magnezyum elementinde ardışık iyonlaşma enerjileri arasındaki
aşırı fark İE ile İE arasında görüldüğünden magnezyum elementi-
2 3
Görsel 1.29: Sodyum atomunda nin değerlik elektron sayısı 2 olup magnezyum elementi 2A grubunda
birinci ve ikinci iyonlaşma enerjisi bulunur.
ile kopan elektronlar
Tablo 1.12: Bazı A Grubu Elementlerinin Elektron Dizilimi ve İlk Dört İyonlaşma Enerjileri
Değerlik
İE İE İE İE Grup
Element Elektron dizilimi 1 2 3 4 Elektron
(kJ/mol) (kJ/mol) (kJ/mol) (kJ/mol) Numarası
Sayısı
2
6
2
Na 1s 2s 2p 3s 1 496 4560 6900 9540 1 1A
11
2
6
Mg 1s 2s 2p 3s 2 738 1450 7730 10500 2 2A
2
12
2
6
2
2
Al 1s 2s 2p 3s 3p 1 578 1820 2750 11600 3 3A
13
Alüminyumun İE ile İE arasındaki fark yaklaşık 3 ile 3,5 kat ara-
2 1
sındadır. İyonlaşma enerjilerindeki yüksek enerji farkının nedeni ise
koparılan ikinci elektronun aynı katmandan olmasına rağmen 3s ka-
2
rarlı elektron diziliminden kopmasıdır. Alüminyumun ardışık iyonlaşma
enerjilerinde aşırı derecede iyonlaşma enerjisi ile kopan elektron İE ile
3
İE arasındadır. Bu nedenle alüminyumun elementinin değerlik elektron
4
sayısı 3 olup alüminyum elementi 3A grubunda bulunur.
56 KİMYA 11. SINIF