Page 46 - Fen Lisesi Kimya 11
P. 46
Örnek
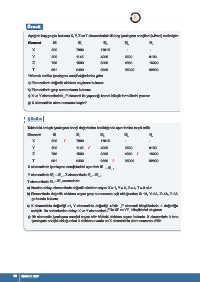
Aşağıda baş grupta bulunan X, Y, Z ve T elementlerinin ilk beş iyonlaşma enerjileri (kJ/mol) verilmiştir:
Element İE İE İE İE İE
1 2 3 4 5
X 520 7300 11815 - -
Y 590 1145 4900 6500 8100
Z 786 1580 3230 4360 16000
T 801 2430 3660 25000 32820
Yukarıda verilen iyonlaşma enerji değerlerine göre
a) Elementlerin değerlik elektron sayılarını bulunuz.
b) Elementlerin grup numaralarını bulunuz.
c) X ve Y elementlerinin F elementi ile yapacağı kararlı bileşik formüllerini yazınız.
9
ç) X elementinin atom numarası kaçtır?
Çözüm
Tablodaki ardışık iyonlaşma enerji değerlerine bakıldığında aşırı farklar tespit edilir.
Element İE İE İE İE İE
1 2 3 4 5
X 520 / 7300 11815 - -
Y 590 1145 / 4900 6500 8100
Z 786 1580 3230 4360 / 16000
T 801 2430 3660 / 25000 32820
X elementinde iyonlaşma enerjisindeki aşırı fark İE – İE ,
1 2
Y elementinde İE – İE , Z elementinde İE – İE ,
2 3 4 5
T elementinde İE – İE arasındadır.
3 4
a) Bundan dolayı elementlerin değerlik elektron sayısı X = 1, Y = 2, Z = 4, T = 3 olur.
b) Elementlerin değerlik elektron sayısı grup numarasına eşit olduğundan X: 1A, Y: 2A, Z: 4A, T: 3A
grubunda bulunur.
c) X elementinin değerliği +1, Y elementinin değerliği +2’dir. F elementi bileşiklerinde -1 değerliğe
9
sahiptir. Bu nedenlerden dolayı X ve Y elementleri F ile XF ve YF bileşiklerini oluşturur.
9 2
ç) Bir elementin iyonlaşma enerjisi sayısı nötr hâldeki elektron sayısı kadardır. X elementinin 3 tane
iyonlaşma enerjisi olduğundan 3 elektronu vardır ve X elementinin atom numarası 3’tür.
58 KİMYA 11. SINIF